题目内容
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一.请回答钢铁在腐蚀、防护过程中的有关问题.
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程的电极反应式为:负极 ,正极 .
(2)下列哪个装置可防止铁棒被腐蚀 .
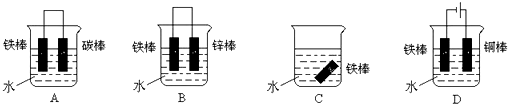
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程的电极反应式为:负极
(2)下列哪个装置可防止铁棒被腐蚀

考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:(1)钢铁吸氧腐蚀的原理是负极上铁失电子,正极上是氧气得电子的过程;
(2)铁为活泼金属,易发生电化学腐蚀,当为原电池负极时,易发生电化学腐蚀,如铁为原电池的正极或外接电源的负极,可防止腐蚀.
(2)铁为活泼金属,易发生电化学腐蚀,当为原电池负极时,易发生电化学腐蚀,如铁为原电池的正极或外接电源的负极,可防止腐蚀.
解答:
解:(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程的电极反应式为:负极:Fe-2e-=Fe2+;正极:O2+4e-+2H2O=4OH-,故答案为:Fe-2e-=Fe2+;O2+4e-+2H2O=4OH-;
(2)A.形成原电池反应,铁为负极,碳为正极,为铁的吸氧腐蚀,故A错误;
B.锌比铁活泼,铁为正极,被保护而难以腐蚀,故B正确;
C.水中溶解氧气,铁可发生腐蚀,故C错误;
D.铁连接电源负极,为阴极,被保护不易腐蚀,故D正确.
故答案为:BD.
(2)A.形成原电池反应,铁为负极,碳为正极,为铁的吸氧腐蚀,故A错误;
B.锌比铁活泼,铁为正极,被保护而难以腐蚀,故B正确;
C.水中溶解氧气,铁可发生腐蚀,故C错误;
D.铁连接电源负极,为阴极,被保护不易腐蚀,故D正确.
故答案为:BD.
点评:本题考查原电池知识,侧重于金属的腐蚀与防护的考查,注意把握原电池的工作原理以及金属的防护方法,难度不大.

练习册系列答案
相关题目
下列关于Na2CO3和NaHCO3的叙述中正确的是( )
| A、可以用加热的方法除去NaHCO3中混有的Na2CO3杂质 |
| B、Na2CO3溶液和NaHCO3溶液分别与足量的盐酸反应的离子方程式相同 |
| C、向Na2CO3和NaHCO3的溶液中分别滴加酚酞溶液,溶液颜色均变红 |
| D、等质量的Na2CO3和NaHCO3分别与足量的盐酸充分反应,Na2CO3产生的CO2多 |
对于已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动,下列有关叙述正确的是( )
①生成物的质量分数一定增加 ②生成物的产量一定增加 ③反应物的转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适的催化剂.
①生成物的质量分数一定增加 ②生成物的产量一定增加 ③反应物的转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适的催化剂.
| A、①② | B、②⑤ | C、③④ | D、④⑥ |
在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述正确的是( )
| A、白色沉淀是BaSO4和BaSO3 |
| B、溶液的酸性减弱 |
| C、白色沉淀是BaSO3 |
| D、溶液中Fe3+全部被还原为Fe2+ |
在下列条件下,各离子组一定能大量共存的是( )
| A、强碱性溶液中:K+、Al3+、Cl-、SO42- |
| B、室温下,pH=0的溶液中:Na+、Fe3+、NO3-、SO42- |
| C、含有1 mol?L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- |
| D、由水电离的c(H+)=1×10-14mol?L-1的溶液中:K+、NH4+、Cl-、SO42- |
 已知:2Fe3++SO32-+H2O?2Fe2++SO42-+2H+.如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极.A杯中为FeCl3溶液;B杯中为Na2SO3溶液.以下关于该装置的说法错误的是( )
已知:2Fe3++SO32-+H2O?2Fe2++SO42-+2H+.如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极.A杯中为FeCl3溶液;B杯中为Na2SO3溶液.以下关于该装置的说法错误的是( )| A、G的指针指向D极 |
| B、U中阳离子向A极移动 |
| C、一段时间后,化学反应达到平衡状态,导线中无电流通过 |
| D、一段时间后,B中溶液pH增大 |
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响同时产生白色烟雾.撞击时发生的化学方程式为:5KC1O3+6P═3P2O5+5KC1,下列有关叙述正确的是( )
| A、上述反应中氧化剂和还原剂的物质的量之比为6:5 |
| B、产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾) |
| C、上述反应中消耗2molP时,转移电子的物质的量为15mol |
| D、因红磷和白磷互为同位素,所以上述火药中的红磷可以用白磷代替 |
N2H4是一种高效清洁的火箭燃料,0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程式中正确的是( )
| A、N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+267 kJ?mol-1 |
| B、N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534 kJ?mol-1 |
| C、N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534 kJ?mol-1 |
| D、N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-133.5 kJ?mol-1 |
下列离子方程式书写不正确的是( )
| A、AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时:2Al3++7OH-=Al(OH)3↓+AlO2-+2H2O |
| B、氨水吸收足量的SO2气体:NH3?H2O+SO2=NH4++HSO3- |
| C、高锰酸钾酸性溶液与草酸溶液反应:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O |
| D、向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |