题目内容
5.如图表示水中c(H+)和c(OH-)的关系.下列判断正确的是( )
| A. | 图中T1>T2 | |
| B. | XZ线上任意点均有pH<7 | |
| C. | 两条曲线间任意点均有c(H+)×c(OH+)═KW=1×10-13 | |
| D. | M区域内任意点对应的溶液中下列离子均可大量共存:S2-、SO42-、Na+、Cl- |
分析 A.水的电离是吸热反应,升高温度促进水电离,则Kw逐渐增大;
B.XZ连线是一条Kw渐渐变大的线;
C.两条曲线间温度不确定;
D.在X、Z连线的上方,c(H+)<c(OH-),在X、Z连线的下方,c(H+)>c(OH-).
解答 解:A.水的电离是吸热反应,升高温度促进水电离,则Kw逐渐增大,Z点Kw大于X点,所以T1<T2,故A错误;
B.XZ连线是一条Kw渐渐变大的线,在X点,pH=7,在X点下方pH大于7,在X上方pH小于7,故B错误;
C.两条曲线间温度不确定,KW不等于1×10-13,故C错误;
D.XZ连线的斜率是1,存在c(H+)=c(OH-),在X、Z连线的上方M区域,c(H+)<c(OH-),在X、Z连线的下方,c(H+)>c(OH-),故M区域显碱性,离子之间不发生任何反应,可共存,故D正确;
故选D.
点评 本题考查了水的电离及影响因素,为高频考点,侧重考查学生的分析能力,题目难度不大,注意明确影响水的电离的因素,明确溶液酸碱性取决于溶液中氢离子与氢氧根离子的浓度大小,不能以溶液的pH判断溶液酸碱性.

练习册系列答案
相关题目
3.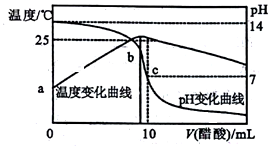 在某温度时,将nmol•L-1醋酸溶液滴入10mL1.0mol•L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将nmol•L-1醋酸溶液滴入10mL1.0mol•L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
 在某温度时,将nmol•L-1醋酸溶液滴入10mL1.0mol•L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将nmol•L-1醋酸溶液滴入10mL1.0mol•L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )| A. | 水的电离程度:c>b | B. | a点Kw比b点大 | ||
| C. | n>1.0 | D. | c点:Ka(CH3COOH)=$\frac{10}{10n+1}$×10-8 |
4.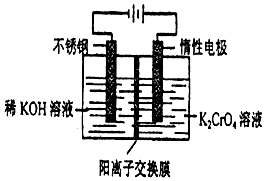 以10L 0.1mol/L铬酸钾(K2CrO4)溶液为原料,电化学法制备重铬酸钾(K2Cr2O7)的实验装置示意图如下,下列说法不正确的是( )
以10L 0.1mol/L铬酸钾(K2CrO4)溶液为原料,电化学法制备重铬酸钾(K2Cr2O7)的实验装置示意图如下,下列说法不正确的是( )
 以10L 0.1mol/L铬酸钾(K2CrO4)溶液为原料,电化学法制备重铬酸钾(K2Cr2O7)的实验装置示意图如下,下列说法不正确的是( )
以10L 0.1mol/L铬酸钾(K2CrO4)溶液为原料,电化学法制备重铬酸钾(K2Cr2O7)的实验装置示意图如下,下列说法不正确的是( )| A. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| B. | 在阴极室,通电后KOH溶液不断变浓,并产生气体H2 | |
| C. | CrO42-通过离子交换膜从阳极区域迁移到阴极区域 | |
| D. | 电解一段时间后测定阳极液中K和Cr的物质的量之比为d,则导线中转移电子的物质的量为(2-d)mol |
13.25℃时,下列有关电解质溶液的说法正确的是( )
| A. | 将Na2CO3溶液用水稀释后,pH变大,Kw不变 | |
| B. | 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变 | |
| C. | pH=4.75浓度均为0.1mol/L的CH3COOH、CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)<c(H+)+c(CH3COOH) | |
| D. | 分别用pH=2和pH=3的CH3COOH溶液中和等物质的量的NaOH,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va>Vb |
20.下列实验方案能达到实验目的是( )
| 选项 | 实验H的 | 实验方案 |
| A | 证明Mg(OH)2沉淀可以转化为 Fe(OH)3 | 向2mL1mol/LNaOH溶液中先加入3滴1mol/LMgCl2溶液,再加入3滴1mol/LFeCl3溶液 |
| B | 比较氯和碳的非属性强弱 | 将盐酸滴入碳酸氢钠溶液中 |
| C | 验证电解饱和食盐水阳极有氯气生成 | 以铁为电极电解饱和食盐水,并将阳极生成的气体通入淀粉-KI溶液 |
| D | 比较铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合溶液 |
| A. | A | B. | B | C. | C | D. | D |
10.下列有关说法不正确的是( )
| A. | “凡造竹纸…用上好石灰化汁涂浆”,造纸利用了石灰的碱性 | |
| B. | “曾青(硫酸铜)涂铁,铁赤色如铜”,过程中发生了置换反应 | |
| C. | 三聚氰胺可用于食品添加剂 | |
| D. | 含Ca(HCO3)2的硬水可通过煮沸的方法使之软化 |
17.下列实验方案能达到实验目的是( )
| 选项 | 实验方案 | 实验目的或结论 |
| A | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 可证明氧化性:H2O2比Fe3+强 |
| B | 向1mL 1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡,再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | 说明Y中不含醛基 |
| C | 取a g铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为V L(已转化为标准状况下) | 测定铝箔中氧化铝的含量 |
| D | 比较不同反应的反应热数据大小 | 从而判断反应速率的大小 |
| A. | A | B. | B | C. | C | D. | D |
14.下列有关化学用语表示正确的是( )
| A. | 中子数为14的铝原子:${\;}_{13}^{14}$Al | B. | 次氯酸的电子式 | ||
| C. | O2-的结构示意图: | D. | 聚四氟乙烯的结构简式: |
15.对于反应N2(g)+3H2(g)?2NH3(g)△H<0,下列说法正确的是( )
| A. | 升高温度,反应放出热量增多 | |
| B. | 恒温恒容下,向达平衡后容器中通入惰性气体,平衡向正反方向移动 | |
| C. | 工业合成氨时采用较高的温度有利于提高生产效率 | |
| D. | 工业合成氨时使用铁作催化剂,有利于提高转化率 |