题目内容
15.对于反应N2(g)+3H2(g)?2NH3(g)△H<0,下列说法正确的是( )| A. | 升高温度,反应放出热量增多 | |
| B. | 恒温恒容下,向达平衡后容器中通入惰性气体,平衡向正反方向移动 | |
| C. | 工业合成氨时采用较高的温度有利于提高生产效率 | |
| D. | 工业合成氨时使用铁作催化剂,有利于提高转化率 |
分析 A.该反应为放热反应,升高温度,平衡逆向移动;
B.恒温恒容下,向达平衡后容器中通入惰性气体,体现中各物质的浓度不变;
C.采用较高的温度,可加快反应速率;
D.使用铁作催化剂,加快反应速率,对平衡移动无影响.
解答 解:A.该反应为放热反应,升高温度,平衡逆向移动,则升高温度,反应放出热量减小,故A错误;
B.恒温恒容下,向达平衡后容器中通入惰性气体,体现中各物质的浓度不变,则平衡不移动,故B错误;
C.采用较高的温度,可加快反应速率,则有利于提高生产效率,故C正确;
D.使用铁作催化剂,加快反应速率,对平衡移动无影响,则不能提高转化率,故D错误;
故选C.
点评 本题考查化学平衡移动,为高频考点,把握温度、浓度对平衡和速率的影响为解答的关键,侧重分析与应用能力的考查,注意选项A为解答的易错点,题目难度不大.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案
相关题目
5.如图表示水中c(H+)和c(OH-)的关系.下列判断正确的是( )


| A. | 图中T1>T2 | |
| B. | XZ线上任意点均有pH<7 | |
| C. | 两条曲线间任意点均有c(H+)×c(OH+)═KW=1×10-13 | |
| D. | M区域内任意点对应的溶液中下列离子均可大量共存:S2-、SO42-、Na+、Cl- |
6.下列说法正确的是( )
| A. | 乙烯可用于制取乙醇,属于水解反应 | |
| B. | 为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤 | |
| C. | 乙醇和葡萄糖均能发生酯化反应 | |
| D. |  的单体是:CH3-C≡C-CH3 和CH2=CH-CN 的单体是:CH3-C≡C-CH3 和CH2=CH-CN |
3.X是某药物的中间体,其结构简式如图所示.下列有关X的说法正确的是( )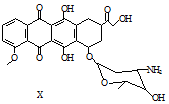

| A. | 每个X分子中含有5个手性碳原子 | |
| B. | 一定条件下,X能与乙醇发生酯化反应 | |
| C. | 一定条件下,X能发生消去反应 | |
| D. | X既能与盐酸反应,又能与NaOH溶液反应 |
10.下列化学用语的表示正确的是( )
| A. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| B. | 1-丁烯的结构简式:CH3CHCHCH3 | |
| C. | HS-的水解方程式:HS-+H2O?S2-+H2O+ | |
| D. | 异丁烷的球棍模型 |
1.用下列实验装置完成对应的实验,不能达到实验目的是( )
| A. |  量取10.00mLNaOH溶液 | |
| B. |  蒸干氯化铜溶液制CuCl2•2H2O | |
| C. | 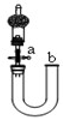 关闭活塞a,从b处加水,以检查装置的气密性 | |
| D. | 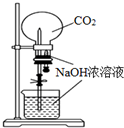 用CO2做喷泉实验 |
8.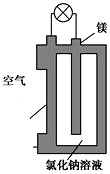 镁燃料电池作为一种高能化学电源,具有比能量高、使用安全方便、成本低、燃料易于贮运、污染小等特点,拥有良好的应用前景.如图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料.下列有关该镁燃料电池的叙述正确的是( )
镁燃料电池作为一种高能化学电源,具有比能量高、使用安全方便、成本低、燃料易于贮运、污染小等特点,拥有良好的应用前景.如图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料.下列有关该镁燃料电池的叙述正确的是( )
 镁燃料电池作为一种高能化学电源,具有比能量高、使用安全方便、成本低、燃料易于贮运、污染小等特点,拥有良好的应用前景.如图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料.下列有关该镁燃料电池的叙述正确的是( )
镁燃料电池作为一种高能化学电源,具有比能量高、使用安全方便、成本低、燃料易于贮运、污染小等特点,拥有良好的应用前景.如图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料.下列有关该镁燃料电池的叙述正确的是( )| A. | 该电池的总反应为2Mg+O2═2MgO | |
| B. | 反应生成O2-,该离子有正极移向负极 | |
| C. | Cl-在阳极失去电子生成Cl2 | |
| D. | 正极反应式为O2+2H2O+4e-═4OH- |
5.设NA为阿伏伽德罗常数的值,下列有关叙述中正确的是( )
| A. | 常温常压下,4.0g H218O与D2O的混合物中所含质子数、中子数均为2NA | |
| B. | 常温常压下,0.1mol/L Na2CO3溶液这所含CO32-的数目小于0.1NA | |
| C. | 用惰性电极电解CuSO4溶液,若电路中通过2NA个电子,则阳极产生11.2L气体 | |
| D. | 35℃时,1L pH=2的 H2SO4溶液中所含H+的数目和1L pH=12的NaOH溶液中所含的OH-的数目均为0.01NA |
5.下列叙述正确的是( )
(1)已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△h=-57.3KJ/mol,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3KJ的热量
(2)向沉淀溶液中加入稀H2SO4加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热,无砖红色沉淀生成,说明沉淀没有水解生成葡萄糖
(3)同一主族的元素,原子半径越大,其单质的熔点不一定越高
(4)乙酸乙酯在NaOH溶液(H218O)中水解产物为CH3CO18ONa和CH3CH2OH
(5)pH=4.3的物质的量的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
(6)在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大( )
(1)已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△h=-57.3KJ/mol,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3KJ的热量
(2)向沉淀溶液中加入稀H2SO4加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热,无砖红色沉淀生成,说明沉淀没有水解生成葡萄糖
(3)同一主族的元素,原子半径越大,其单质的熔点不一定越高
(4)乙酸乙酯在NaOH溶液(H218O)中水解产物为CH3CO18ONa和CH3CH2OH
(5)pH=4.3的物质的量的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
(6)在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大( )
| A. | (1)(2)(5)(6) | B. | (3)(4)(5) | C. | (2)(3)(5)(6) | D. | (1)(2)(3)(4)(5) |