题目内容
10.下列有关说法不正确的是( )| A. | “凡造竹纸…用上好石灰化汁涂浆”,造纸利用了石灰的碱性 | |
| B. | “曾青(硫酸铜)涂铁,铁赤色如铜”,过程中发生了置换反应 | |
| C. | 三聚氰胺可用于食品添加剂 | |
| D. | 含Ca(HCO3)2的硬水可通过煮沸的方法使之软化 |
分析 A.石灰水为氢氧化钙水溶液,可用于除去原料中的杂质;
B.铁赤色如铜,说明生成铜;
C.三聚氰胺对人体有害;
D.Ca(HCO3)2不稳定,加热可分解.
解答 解:A.石灰水为氢氧化钙水溶液,可用于除去原料中的杂质,与石灰的碱性有关,故A正确;
B.铁赤色如铜,说明生成铜,为置换反应,故B正确;
C.三聚氰胺对人体有害,不能用作添加剂,故C错误;
D.Ca(HCO3)2不稳定,加热可分解,则含Ca(HCO3)2的硬水可通过煮沸的方法使之软化,故D正确.
故选C.
点评 本题考查物质的组成、性质,为高频考点,侧重于化学与生活、环境的考查,有利于培养学习的良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
相关题目
8.利用如图所示的装置可将CO2转化为燃料甲醇,下列说法正确的是( )


| A. | b极发生还原反应 | |
| B. | a极的电极反应:CH3OH+H2O-6e-═CO2+6H+ | |
| C. | 总反应方程式为:2CO2+4H2O$\frac{\underline{\;通电\;}}{\;}$2CH3OH+3O2 | |
| D. | 该装置将化学能转变为电能 |
1.不同元素的原子在分子内吸引电子的能力大小可用一数值X来表示,若X越大,则原子吸引电子的能力越强,在所形成的分子中成为负电荷一方.下面是某些短周期元素的X值.
(1)通过分析X值的变化规律,确定N、Mg的X值范围:0.93<X(Mg)<1.57;2.55<X(N)<3.44.
(2)推测X值与原子半径的关系是同周期(或同主族)元素,x值越大,原子半径越小.
(3)某有机物结构简式为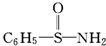 ,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
(4)经验规律告诉我们当成键的两原子相应元素电负性的差值△X>1.7时,一般为离子键,当△X<1.7时,一般为共价键,试推断AlBr3中化学键的类型是共价键
(5)预测元素周期表中,X值最小的元素位置第六周期第ⅠA族(放射性元素除外).
| 元素 | Li | Be | B | C | O | F |
| X值 | 0.98 | 1.57 | 2.04 | 2.53 | 3.44 | 3.98 |
| 元素 | Na | Al | Si | P | S | Cl |
| X值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)推测X值与原子半径的关系是同周期(或同主族)元素,x值越大,原子半径越小.
(3)某有机物结构简式为
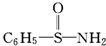 ,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).(4)经验规律告诉我们当成键的两原子相应元素电负性的差值△X>1.7时,一般为离子键,当△X<1.7时,一般为共价键,试推断AlBr3中化学键的类型是共价键
(5)预测元素周期表中,X值最小的元素位置第六周期第ⅠA族(放射性元素除外).
18.化学与我们的生活息息相关,下列有关说法正确的是( )
| A. | SO2、NO2都是酸性氧化物,分别能形成硫酸型酸雨和硝酸型酸雨 | |
| B. | 明矾[KAl(SO4)2•l2H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| C. | 高铁车厢大部分材料是铝合金,铝合金材料具有强度大、质量轻、抗腐蚀能力强等优点 | |
| D. | 日常生活中常用汽油去除衣物上的油污,用热的纯碱溶液洗涤炊具上的油污,两者的原理完全相同 |
5.如图表示水中c(H+)和c(OH-)的关系.下列判断正确的是( )


| A. | 图中T1>T2 | |
| B. | XZ线上任意点均有pH<7 | |
| C. | 两条曲线间任意点均有c(H+)×c(OH+)═KW=1×10-13 | |
| D. | M区域内任意点对应的溶液中下列离子均可大量共存:S2-、SO42-、Na+、Cl- |
15.化学与生产、生活、社会密切相关,下列说法正确的是( )
| A. | 明矾和漂白粉常用于自来水的净化,且原理相同 | |
| B. | 绚丽缤纷的烟花中添加了含钾、钠、铁、铜等金属元素的化合物 | |
| C. | 食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质 | |
| D. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
2.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 电解饱和食盐水,阳极产生22.4L气体时,电路中通过的电子数目为2NA | |
| B. | 1L0.1mol•L-1碳酸钠溶液中含有的氧原子数为0.3NA | |
| C. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 0.1 mol乙烯和乙醇的混合物完全燃烧所消耗的氧分子数为0.3NA |
19. 20℃时,在 c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4、NaOH 混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示.下列说法正确的是( )
20℃时,在 c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4、NaOH 混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示.下列说法正确的是( )
 20℃时,在 c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4、NaOH 混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示.下列说法正确的是( )
20℃时,在 c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4、NaOH 混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示.下列说法正确的是( )| A. | 0.100 mol•L-1的NaHC2O4溶液中:c(OH-)═c(H+)-2c(C2O42-)+c(H2C2O4) | |
| B. | Q点:c(H2C2O4)+c(C2O42-)>c(HC2O4-) | |
| C. | P点:c(Na+)+c(H2C2O4)<0.100 mol•L-1+c(HC2O4-) | |
| D. | 该温度下H2C2O4的电离平衡常数Ka2=1×10-42mol•L-1 |
1.用下列实验装置完成对应的实验,不能达到实验目的是( )
| A. | 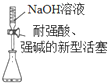 量取10.00mLNaOH溶液 | |
| B. | 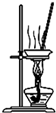 蒸干氯化铜溶液制CuCl2•2H2O | |
| C. | 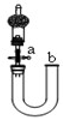 关闭活塞a,从b处加水,以检查装置的气密性 | |
| D. | 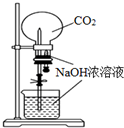 用CO2做喷泉实验 |