题目内容
9.将100mL 0.6mol/L的盐酸与100mL 0.4mol/L的氢氧化钡溶液混合,反应后溶液体积为200mL,则混合溶液中OH-物质的量浓度为( )| A. | 0.4 mol/L | B. | 0.2mol/L | C. | 0.1mol/L | D. | 0.05mol/L |
分析 n(HCl)=0.1L×0.6mol/L=0.06mol,n(OH-)=0.1L×0.4mol/L×2=0.08mol,则混合后碱过量,结合c=$\frac{n}{V}$计算.
解答 解:n(HCl)=0.1L×0.6mol/L=0.06mol,n(OH-)=0.1L×0.4mol/L×2=0.08mol,则混合后碱过量,
剩余的OH-物质的量为0.08mol-0.06mol=0.02mol,
反应后溶液体积为200mL,则混合溶液中OH-物质的量浓度为$\frac{0.02mol}{0.2L}$=0.1mol/L,
故选C.
点评 本题考查物质的量浓度的计算,为高频考点,把握酸碱中和的实质及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意混合时过量判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.能正确表示下列化学反应的离子方程式是( )
| A. | 氢氧化钡溶液与稀硫酸的反应:OH-+H++Ba2++SO42-=BaSO4↓+H2O | |
| B. | 硫酸铝溶液中加入过量氨水:Al3++4OH-═[Al(OH)4]- | |
| C. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| D. | 碳酸钙溶于稀盐酸中:CO32-+2H+=H2O+CO2↑ |
20.能将NH4Cl、AlCl3、Na2SO4三瓶溶液鉴别开的试剂是( )
| A. | NaOH 溶液 | B. | AgNO3 溶液 | C. | BaCl2 溶液 | D. | 盐酸 |
17.25℃时,将物质的量浓度相同的NaOH 溶液和CH3COOH溶液等体积相混合后,下列关系式中正确的是( )
| A. | c(H+)=c(CH3COO-)+c(OH-) | B. | c (Na+)>c (CH3COO-)>c(OH-)>c(H+) | ||
| C. | c(Na+)=c(CH3COO-)>c(OH-)=c(H+) | D. | c (CH3COO-)>c(Na+)>c(H+)>c(OH-) |
4.下列各组离子,在酸性溶液中能大量共存的是( )
| A. | Ba2+ K+ OH- NO3- | B. | Na+ Ca2+ HCO3- NO3- | ||
| C. | Ag+ K+ Cl- NO3- | D. | Na+ Cu2+ SO42- Cl- |
1.下列说法正确的是( )
| A. | 分子晶体中一定存在共价键和范德华力 | |
| B. | 由非金属元素组成的化合物一定是共价化合物 | |
| C. | 原子晶体和分子晶体一定均含有共价键,离子晶体也可能含有共价键 | |
| D. | 两个非金属元素原子间不可能形成离子键 |
18.下列有关说法正确的是( )
| A. | 煤的气化就是将煤在高温条件由固态转化为气态的物理变化过程 | |
| B. |  和 和 互为同分异构体 互为同分异构体 | |
| C. | 淀粉、蛋白质和油脂都是高聚物,在一定条件下都能水解 | |
| D. | 石油裂解可以得到更多的汽油,这种汽油是一种纯净物 |
19.Na2CO3的制取方法及Na2CO3和NaHCO3综合实验探究
Ⅰ.(1)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如图:
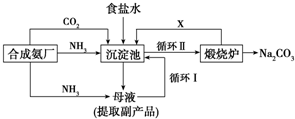
①往饱和食盐水中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是由于CO2在NaCl溶液中的溶解度很小,NH3在水中溶解度较大,先通入NH3使食盐水呈碱性,能够吸收大量CO2气体,产生较高浓度的HCO3-,才能析出NaHCO3晶体.
②写出沉淀池中反应的化学方程式NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓.
Ⅱ.某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(2)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液.
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:相同温度下,Na2CO3比NaHCO3易溶于水.
②同学们在两烧杯中还观察到以下现象.其中,盛放Na2CO3的烧杯中出现的现象是b、d(填字母序号).
a.溶液温度下降
b.溶液温度升高
c.滴入酚酞后呈浅红色
d.滴入酚酞后呈红色
(4)同学们将两种固体分别配制成0.5mol•L-1的溶液,设计如表方案并对反应现象做出预测:
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为Ca2++2HCO3-═CaCO3↓+CO2↑+H2O.
Ⅰ.(1)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如图:

①往饱和食盐水中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是由于CO2在NaCl溶液中的溶解度很小,NH3在水中溶解度较大,先通入NH3使食盐水呈碱性,能够吸收大量CO2气体,产生较高浓度的HCO3-,才能析出NaHCO3晶体.
②写出沉淀池中反应的化学方程式NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓.
Ⅱ.某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(2)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液.
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:相同温度下,Na2CO3比NaHCO3易溶于水.
②同学们在两烧杯中还观察到以下现象.其中,盛放Na2CO3的烧杯中出现的现象是b、d(填字母序号).
a.溶液温度下降
b.溶液温度升高
c.滴入酚酞后呈浅红色
d.滴入酚酞后呈红色
(4)同学们将两种固体分别配制成0.5mol•L-1的溶液,设计如表方案并对反应现象做出预测:
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应:Ca2++CO32-═CaCO3↓ (离子方程式) |
| 操作2:向2mL NaHCO3溶液中滴加1mL 0.5mol•L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |