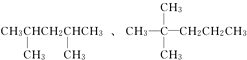题目内容
 研究化学反应,不仅要关注反应的速率、方向性,还要关注反应进行的限度以及反应过程中的能量变化.
研究化学反应,不仅要关注反应的速率、方向性,还要关注反应进行的限度以及反应过程中的能量变化.(1)已知298K时:①Cl-Cl→2Cl△H=+akJ?mol-1;
②2H→H-H△H=-bkJ?mol-1;
③Cl+H→HCl△H=-ckJ?mol-1
写出H2在Cl2中燃烧的热化学方程式
(2)已知CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H<0,向一个2L的密闭容器中通入0.5molCH4和一定量的NO2,分别在130℃和180℃下反应,n(CH4)随时间变化如表所示:
| 0 | 1min | 2min | 4min | 5min | |
| 130℃ | 0.50mol | 0.35mol | 0.25mol | 0.10mol | 0.10mol |
| 180℃ | 0.50mol | 0.30mol | 0.18mol | 0.15mol |
②180℃时,反应到4min,体系
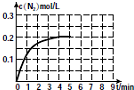
③在某温度下,反应过程中c(N2)随时间变化如图所示.在5min时升高温度,在第8min达到新的平衡时CH4的转化率为70%,请在图中画出5-9min时c(N2)的变化曲线.
(3)某低温脱硝技术可用于处理废气中的氮氧化物,其反应的平衡常数表达式为:K=
| c2(N2)?c2(H2O) |
| c2(NH3)?c(NO)?c(NO2) |
①该反应的逆反应能否自发进行
②在180℃时该反应的催化剂活性最高,在不改变温度的情况下,能提高氮氧化物处理率的措施有
考点:热化学方程式,焓变和熵变,物质的量或浓度随时间的变化曲线
专题:化学反应中的能量变化,化学平衡专题
分析:(1)根据反应热△H=(断键吸收的热量-成键放出的热量)KJ/mol来计算;
(2)①根据v=
来进行计算;
②根据温度对反应速率和平衡的影响来判断;
③根据升温,平衡左移,得出c(N2)的浓度得在0.2mol/L的基础上下降,根据在第8min达到新的平衡时CH4的转化率为70%,得出氮气的平衡浓度,从而画出图象.
(3)①通过平衡常数的表达式写出反应方程式,通过吉布斯自由能来判断反应能否自发进行;
②提高氮氧化物处理率,即使平衡右移,可以通过改变压强或增大氨气的浓度来实现.
(2)①根据v=
| △C |
| △t |
②根据温度对反应速率和平衡的影响来判断;
③根据升温,平衡左移,得出c(N2)的浓度得在0.2mol/L的基础上下降,根据在第8min达到新的平衡时CH4的转化率为70%,得出氮气的平衡浓度,从而画出图象.
(3)①通过平衡常数的表达式写出反应方程式,通过吉布斯自由能来判断反应能否自发进行;
②提高氮氧化物处理率,即使平衡右移,可以通过改变压强或增大氨气的浓度来实现.
解答:
解:(1)根据H2在Cl2中燃烧的化学方程式:H2 +Cl2 =2HCl可知,断键吸收的热量为(a+b)KJ/mol,成键吸收的热量为2CKJ/mol,故热化学方程式为:
H2(g)+Cl2 (g)=2HCl(g)△H=断键吸收的热量-成键放出的热量=(a+b-2c)KJ/mol,
故答案为:H2(g)+Cl2 (g)=2HCl(g)△H=(a+b-2c)KJ/mol
(2)①根据表中信息可知,△n(CH4)=0.25mol,根据物质的量的该变量之比等于计量数之比可知,△n(H2O)=0.5mol,△C(H2O)=0.25mol/L,即根据可知:
v(H2O)=
=0.125mol?L-1?min-1,故答案为:0.125mol?L-1?min-1
②对比实验1知,4min时该反应已经达到平衡状态.因为温度越高,反应速率越大,反应到达平衡的时间越短,所以40时实验2已经达平衡状态.
故答案为:是;温度升高,加快f反应速率,对比实验1,高温下比低温下更快达到平衡状态.故可确定4min时反应已经达平衡状态;
③从反应可知,升温,平衡左移,得出c(N2)的浓度得在0.2mol/L的基础上下降,根据在第8min达到新的平衡时CH4的转化率为70%,可知△n(CH4)=0.35mol,根据物质的量的改变量之比等于计量数之比,可知△n(N2)=0.35mol,即达平衡时氮气的浓度为C(N2)=0.175mol/L,即图象的起点为0.2mol/L,重点为8min时的0.175mol/L,答案如图所示: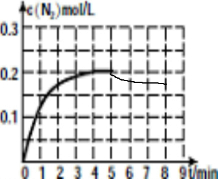 ,
,
故答案为: ;
;
(3)①通过化学平衡常数的表达式K=
可知,化学方程式为:2NH3 +NO+NO2 ?2N2+2H2O,由于升高反应温度,K值变小,即正反应△H<0,故逆反应的△H>0,△S<0,则△G=△H-T?△S>0,故反应非自发,故答案为:不能,逆反应的△H>0,△S<0,则△G=△H-T?△S>0,故反应非自发.
②通过对题意的分析,可知在催化剂活性最高,在不改变温度的情况下提高氮氧化物处理率,即使平衡右移,可以通过减小压强或增大氨气的浓度来实现.
故答案为:减小压强、增大氨气的浓度.
H2(g)+Cl2 (g)=2HCl(g)△H=断键吸收的热量-成键放出的热量=(a+b-2c)KJ/mol,
故答案为:H2(g)+Cl2 (g)=2HCl(g)△H=(a+b-2c)KJ/mol
(2)①根据表中信息可知,△n(CH4)=0.25mol,根据物质的量的该变量之比等于计量数之比可知,△n(H2O)=0.5mol,△C(H2O)=0.25mol/L,即根据可知:
v(H2O)=
| 0.25mol/L |
| 2L |
②对比实验1知,4min时该反应已经达到平衡状态.因为温度越高,反应速率越大,反应到达平衡的时间越短,所以40时实验2已经达平衡状态.
故答案为:是;温度升高,加快f反应速率,对比实验1,高温下比低温下更快达到平衡状态.故可确定4min时反应已经达平衡状态;
③从反应可知,升温,平衡左移,得出c(N2)的浓度得在0.2mol/L的基础上下降,根据在第8min达到新的平衡时CH4的转化率为70%,可知△n(CH4)=0.35mol,根据物质的量的改变量之比等于计量数之比,可知△n(N2)=0.35mol,即达平衡时氮气的浓度为C(N2)=0.175mol/L,即图象的起点为0.2mol/L,重点为8min时的0.175mol/L,答案如图所示:
 ,
,故答案为:
 ;
;(3)①通过化学平衡常数的表达式K=
| c2(N2)?c2(H2O) |
| c2(NH3)?c(NO)?c(NO2) |
②通过对题意的分析,可知在催化剂活性最高,在不改变温度的情况下提高氮氧化物处理率,即使平衡右移,可以通过减小压强或增大氨气的浓度来实现.
故答案为:减小压强、增大氨气的浓度.
点评:本题综合考查了热化学方程式的书写、反应速率的求算、平衡的移动和图象问题,综合性较强,难度较大.

练习册系列答案
相关题目
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子的外围电子排布式为3s23p6的是( )
| A、W2- |
| B、X+ |
| C、Y3- |
| D、Z2- |
常温下,下列溶液pH小于7的是( )
| A、CH3COONa |
| B、CuSO4 |
| C、NaHCO3 |
| D、Na2CO3 |

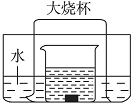 如图所示的实验装置,向盛有足量水的水槽里放两个烧杯,小烧杯里放有适量的铜片和过量的浓硝酸,小烧杯外面倒扣一个大烧杯,请回答下列问题:
如图所示的实验装置,向盛有足量水的水槽里放两个烧杯,小烧杯里放有适量的铜片和过量的浓硝酸,小烧杯外面倒扣一个大烧杯,请回答下列问题: