题目内容
(1)氯气用于被誉为“战略金属”的钛的制备,其中有关反应为:TiO2+2C+2Cl2
TiCl4+2CO
在上述反应中双线桥标出电子转移的方向和数目 ,反应中表现氧化剂的物质是 ,被氧化的物质是 .
(2)生活中所用的漂白液可用氯气来制取,漂白液的有效成分是 ;制备反应的离子方程式为 ;反应中氧化剂与还原剂的物质的量之比为 .
(3)漂白粉贮存时需密闭保存,其原因是 ;在印染工业上用漂白粉漂白棉布时,需加入少量稀盐酸,其原理是 (用离子方程式表示).
| ||
在上述反应中双线桥标出电子转移的方向和数目
(2)生活中所用的漂白液可用氯气来制取,漂白液的有效成分是
(3)漂白粉贮存时需密闭保存,其原因是
考点:氧化还原反应,氯气的化学性质,氯、溴、碘及其化合物的综合应用
专题:氧化还原反应专题
分析:(1)TiO2+2C+2Cl2
TiCl4+2CO中,C元素的化合价升高,Cl元素的化合价降低,该反应转移4e-;
(2)氯气与NaOH反应制备漂白液,氯气既是氧化剂也是还原剂;
(3)漂白粉与空气中的水、二氧化碳反应生成HClO,漂白粉与稀盐酸反应生成次氯酸和氯化钙.
| ||
(2)氯气与NaOH反应制备漂白液,氯气既是氧化剂也是还原剂;
(3)漂白粉与空气中的水、二氧化碳反应生成HClO,漂白粉与稀盐酸反应生成次氯酸和氯化钙.
解答:
解:(1)TiO2+2C+2Cl2
TiCl4+2CO中,C元素的化合价升高,则C被氧化,Cl元素的化合价降低,则Cl2为氧化剂,该反应转移4e-,双线桥标出电子转移的方向和数目为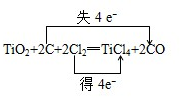 ,故答案为:
,故答案为: ;Cl2;C;
;Cl2;C;
(2)氯气与NaOH反应制备漂白液,发生Cl2+2OH-=Cl-+ClO-+H2O,漂白液的有效成分是NaClO,氯气既是氧化剂也是还原剂,则氧化剂与还原剂的物质的量之比为1:1,故答案为:NaClO;Cl2+2OH-=Cl-+ClO-+H2O;1:1;
(3)漂白粉与空气中的水、二氧化碳反应生成HClO,HClO分解生成HCl和氧气,使其漂白失效,则应密闭保存,漂白粉与稀盐酸反应生成次氯酸和氯化钙,反应为Ca(ClO)2 +2HCl=2HClO+CaCl2,离子反应为ClO-+H+=HClO,
故答案为:漂白粉与空气中的水、二氧化碳反应生成HClO,HClO分解生成HCl和氧气;ClO-+H+=HClO.
| ||
 ,故答案为:
,故答案为: ;Cl2;C;
;Cl2;C;(2)氯气与NaOH反应制备漂白液,发生Cl2+2OH-=Cl-+ClO-+H2O,漂白液的有效成分是NaClO,氯气既是氧化剂也是还原剂,则氧化剂与还原剂的物质的量之比为1:1,故答案为:NaClO;Cl2+2OH-=Cl-+ClO-+H2O;1:1;
(3)漂白粉与空气中的水、二氧化碳反应生成HClO,HClO分解生成HCl和氧气,使其漂白失效,则应密闭保存,漂白粉与稀盐酸反应生成次氯酸和氯化钙,反应为Ca(ClO)2 +2HCl=2HClO+CaCl2,离子反应为ClO-+H+=HClO,
故答案为:漂白粉与空气中的水、二氧化碳反应生成HClO,HClO分解生成HCl和氧气;ClO-+H+=HClO.
点评:本题考查氧化还原反应及氯气的化学性质,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,注意氯气在生活、生产中重要应用,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将下列物质的水溶液蒸干并灼烧,能得到溶质的是( )
| A、NaHCO3 |
| B、Na2CO3 |
| C、AlCl3 |
| D、NH4HCO3 |
鉴别胶体和溶液可以采用的最好方法是( )
| A、闻气味 | B、观察 |
| C、稀释 | D、丁达尔现象 |
阿司匹林是日常生活中应用广泛的医药之一,它可由下列方法合成:( )


| A、邻羟基苯甲醇分子中所有的原子可能在同一平面 |
| B、用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应① |
| C、邻羟基苯甲酸的化学式为C7H6O3 |
| D、1mol邻羟基苯甲醛最多能与3mol H2发生加成反应 |

 研究化学反应,不仅要关注反应的速率、方向性,还要关注反应进行的限度以及反应过程中的能量变化.
研究化学反应,不仅要关注反应的速率、方向性,还要关注反应进行的限度以及反应过程中的能量变化.