题目内容
常温下,下列溶液pH小于7的是( )
| A、CH3COONa |
| B、CuSO4 |
| C、NaHCO3 |
| D、Na2CO3 |
考点:盐类水解的应用
专题:盐类的水解专题
分析:常温下,酸溶液或强酸弱碱盐溶液pH小于7,据此分析解答.
解答:
解:A.CH3COONa是强碱弱酸盐,醋酸根离子水解导致其溶液呈碱性,pH>7,故A错误;
B.CuSO4是强酸弱碱盐,铜离子水解导致溶液呈酸性,pH<7,故B正确;
C.NaHCO3是强碱弱酸酸式盐,碳酸根离子水解程度大于电离程度,导致溶液呈碱性,pH>7,故C错误;
D.Na2CO3是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,pH>7,且碳酸根离子水解程度大于碳酸氢根离子,故D错误;
故选B.
B.CuSO4是强酸弱碱盐,铜离子水解导致溶液呈酸性,pH<7,故B正确;
C.NaHCO3是强碱弱酸酸式盐,碳酸根离子水解程度大于电离程度,导致溶液呈碱性,pH>7,故C错误;
D.Na2CO3是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,pH>7,且碳酸根离子水解程度大于碳酸氢根离子,故D错误;
故选B.
点评:本题考查了盐类水解,明确盐类水解存在“谁强谁显性、谁弱谁水解、强强显中性”即可解答,题目难度不大.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A、24g NaH中阴离子所含电子总数为NA |
| B、1mol苯分子中含有3NA个碳碳单键 |
| C、NO2和H2O反应毎生成2mol HNO3时转移的电子数目为2NA |
| D、含0.2 NA个K+的K2SO4固体溶解于1 L水中,所得溶液浓度为0.1mol?L-1 |
下列电子式书写正确的是( )
A、氯化钠 |
B、氨气 |
C、氯化钙 |
D、硫化钠 |
化学在生产和日常生活中有着重要的应用.下列叙述正确的是( )
| A、单质硅是将太阳能转化为电能的常用材料 |
| B、硅酸钠的俗名为玻璃,可用于制备硅胶和木材防火剂 |
| C、用浓H2SO4刻蚀工艺玻璃上的纹饰 |
| D、SO2具有氧化性,可用来漂白纸浆 |
 向甲、乙两个容积均为1L的恒容容器中,分别通入2mol A、2mol B和1mol A、1mol B.相同条件下,发生反应:A(g)+B(g)?xC(g)△H<0,测得两容器中c(A) 随时间t的变化如图.下列说法正确的是
向甲、乙两个容积均为1L的恒容容器中,分别通入2mol A、2mol B和1mol A、1mol B.相同条件下,发生反应:A(g)+B(g)?xC(g)△H<0,测得两容器中c(A) 随时间t的变化如图.下列说法正确的是( )
| A、x等于2 |
| B、向平衡后的乙容器中充入氦气可使c(A)增大 |
| C、将甲容器单独升温可使甲容器内各物质的体积分数与乙容器内的相同 |
| D、若向甲中再充2mol A、2mol B,则平衡时甲中c(A)>1.56mol/L |
鉴别胶体和溶液可以采用的最好方法是( )
| A、闻气味 | B、观察 |
| C、稀释 | D、丁达尔现象 |
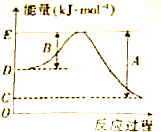 下表列出了断裂某些化学键的热量值
下表列出了断裂某些化学键的热量值 研究化学反应,不仅要关注反应的速率、方向性,还要关注反应进行的限度以及反应过程中的能量变化.
研究化学反应,不仅要关注反应的速率、方向性,还要关注反应进行的限度以及反应过程中的能量变化.