题目内容
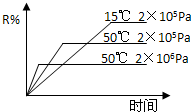 在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2X,该反应中R的体积分数如图所示,下列情况正确的是( )
在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2X,该反应中R的体积分数如图所示,下列情况正确的是( )| A、正反应为吸热反应,X为气体 |
| B、正反应为吸热反应,X为固体或液体 |
| C、正反应为放热反应,X为气体 |
| D、正反应为放热反应,X为固体或液体 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:升高温度,化学平衡向着吸热方向进行,反之向着放热方向进行,增大压强,化学平衡向着气体系数和减小的方向进行,反之向着气体系数和增大的方向进行.
解答:
解:根据图示信息知道,压强不变,温度升高,R的百分含量减小,所以化学平衡逆向移动,说明正向是一个放热反应;
温度不变,增大压强,R的含量减少,说明平衡向逆反应方向移动,则正反应是气体增大的反应,则X为液体或固体,
故选:D.
温度不变,增大压强,R的含量减少,说明平衡向逆反应方向移动,则正反应是气体增大的反应,则X为液体或固体,
故选:D.
点评:本题考查化学平衡图象问题,难度不大,本题注意根据图象判断问题、压强的大小,根据温度、压强对平衡移动的影响分析.

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
能正确表示下列化学反应的离子方程式是( )
| A、向澄清石灰水中通少量二氧化碳:Ca(OH)2+CO2=CaCO3↓+H2O |
| B、稀盐酸与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| C、锌片插入硝酸银溶液中:Zn+2Ag+=Zn2++2Ag |
| D、硫酸钠溶液与氯化镁溶液的反应:SO42-+Mg2+=MgSO4↓ |
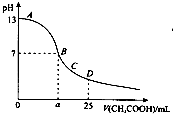 常温下,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是( )
常温下,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是( )| A、在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、在B点a>12.5,且有:c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| C、在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| D、在D点:c(CH3COO-)+c(CH3COOH)=2 c(Na+) |
已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32- ②
向0.1mol?L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32- ②
向0.1mol?L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
| A、加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | ||||||||
B、加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+
| ||||||||
C、加入少量NaOH溶液,
| ||||||||
| D、加入NaOH溶液至中性,则c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
在容量瓶上无需有的标记是( )
| A、刻度线 | B、温度 | C、浓度 | D、容量 |
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、78g 苯含有C=C双键的数目为3NA |
| B、常室温下,1LpH=13的Ba(OH)溶液中,溶液中的OH-离子数目为0.2NA |
| C、0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA |
| D、含2molH2SO4的浓硫酸与足量铜片在加热条件下反应,产生NA个SO2气体分子 |
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: