题目内容
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.其反应如下:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)+Q,完成下列填空:
(1)在一定温度下,向体积为2L的恒容密闭容器中充入4mol CO2 (g)和6mol H2 (g),2min后,测得混合气体的压强是反应前的0.85倍,则CO2的平均反应速率为 .
(2)一定条件下,在恒容密闭容器中,能表示上述可逆反应达到平衡状态的是(填序号) .
a.v正(CH3CH2OH)=v正(CO2)
b.3v逆(CO2)=v正(H2)
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变.
如图所示,P是可自由平行滑动的活塞,关闭K2,在相同温度下,通过K1、K3分别向A、B中各充入2mol CO2 和3mol H2,关闭K1、K3,反应起始时A、B的体积相同均为a L.
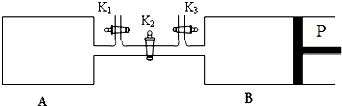
(3)反应达到平衡后A内压强为起始压强的0.8倍,则H2转化率为 .
(4)①若在平衡后B容器中再充入1mol CO2和1.5mol H2,则重新到达平衡后,平衡混合气中CH3CH2OH的体积分数 (填“变大”“变小”或“不变”).
②若在平衡后打开K2,再次达到平衡后B容器的体积缩至0.6a L,则打开K2之前,B容器的体积为 L.
(1)在一定温度下,向体积为2L的恒容密闭容器中充入4mol CO2 (g)和6mol H2 (g),2min后,测得混合气体的压强是反应前的0.85倍,则CO2的平均反应速率为
(2)一定条件下,在恒容密闭容器中,能表示上述可逆反应达到平衡状态的是(填序号)
a.v正(CH3CH2OH)=v正(CO2)
b.3v逆(CO2)=v正(H2)
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变.
如图所示,P是可自由平行滑动的活塞,关闭K2,在相同温度下,通过K1、K3分别向A、B中各充入2mol CO2 和3mol H2,关闭K1、K3,反应起始时A、B的体积相同均为a L.

(3)反应达到平衡后A内压强为起始压强的0.8倍,则H2转化率为
(4)①若在平衡后B容器中再充入1mol CO2和1.5mol H2,则重新到达平衡后,平衡混合气中CH3CH2OH的体积分数
②若在平衡后打开K2,再次达到平衡后B容器的体积缩至0.6a L,则打开K2之前,B容器的体积为
考点:化学平衡的计算,反应速率的定量表示方法,化学平衡状态的判断
专题:化学平衡专题
分析:(1)依据化学平衡三段式列式计算,气体压强之比等于物质的量之比;
(2)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
(3)在AB中发生反应CO(g)+2H2(g)═CH3OH(g),依据三段式法解答,注意相同体积时,气体的压强之比等于气体的物质的量之比;
(4)①根据等效平衡进行判断;
②压强相等时,气体的体积之比等于物质的量之比.
(2)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
(3)在AB中发生反应CO(g)+2H2(g)═CH3OH(g),依据三段式法解答,注意相同体积时,气体的压强之比等于气体的物质的量之比;
(4)①根据等效平衡进行判断;
②压强相等时,气体的体积之比等于物质的量之比.
解答:
解:(1)设反应的二氧化碳的物质的量为x
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)+Q
起始量(mol) 4 6 0 0
变化量(mol) x 3x 0.5x 1.5x
2min量(mol) 4-x 6-3x 0.5x 1.5x
2min后,测得混合气体的压强是反应前的0.85倍,则(4-x)+(6-3x)+0.5x+1.5x=0.85×(4+6),x=0.75mol,v(CO2)=
=0.1875mol/(L?min);
故答案为:0.1875mol/(L?min);
(2)2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)+Q
a.v正(CH3CH2OH)=v正(CO2),都是正反应,不能说明达到平衡状态;
b.3v逆(CO2)=v正(H2),且化学反应速率之比等于化学计量数之比,故正逆反应速率相等,故b正确;
c.密度=
,总质量不变,体积不变,故混合气体的密度保持不变不能说明达到平衡状态,故c错误;
d.平均相对分子质量=
,总质量不变,总物质的量会变,故混合气体的平均相对分子质量保持不变能说明达到平衡状态,故d正确,
故答案为:bd;
(3)2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)+Q
起始量(mol) 2 3 0 0
变化量(mol) x 3x 0.5x 1.5x
2min量(mol) 2-x 3-3x 0.5x 1.5x
气体的压强之比等于气体的物质的量之比,则(2-x)+(3-3x)+0.5x+1.5x=0.8×(2+3),解得:x=0.5mol,平衡时氢气的转化率为:
×100%=50%,
故答案为:50%;
(4)①原投料比n(CO2):n(H2)=2:3,现在平衡后B容器中再充入1mol CO2和1.5mol H2,投料比与原投料比相同,恒温恒压,故两者为等效平衡,故平衡混合气中CH3CH2OH的体积分数不变,
故答案为:不变
②打开K2,AB都是恒压环境,AB的体积共缩小了0.4aL,A与B体积相等,则A与B各缩小了0.2aL,则打开K2之前,B容器的体积为0.8aL,
故答案为:0.8a.
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)+Q
起始量(mol) 4 6 0 0
变化量(mol) x 3x 0.5x 1.5x
2min量(mol) 4-x 6-3x 0.5x 1.5x
2min后,测得混合气体的压强是反应前的0.85倍,则(4-x)+(6-3x)+0.5x+1.5x=0.85×(4+6),x=0.75mol,v(CO2)=
| ||
| 2 |
故答案为:0.1875mol/(L?min);
(2)2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)+Q
a.v正(CH3CH2OH)=v正(CO2),都是正反应,不能说明达到平衡状态;
b.3v逆(CO2)=v正(H2),且化学反应速率之比等于化学计量数之比,故正逆反应速率相等,故b正确;
c.密度=
| 总质量 |
| 体积 |
d.平均相对分子质量=
| 总质量 |
| 总物质的量 |
故答案为:bd;
(3)2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)+Q
起始量(mol) 2 3 0 0
变化量(mol) x 3x 0.5x 1.5x
2min量(mol) 2-x 3-3x 0.5x 1.5x
气体的压强之比等于气体的物质的量之比,则(2-x)+(3-3x)+0.5x+1.5x=0.8×(2+3),解得:x=0.5mol,平衡时氢气的转化率为:
| 0.5×3 |
| 3 |
故答案为:50%;
(4)①原投料比n(CO2):n(H2)=2:3,现在平衡后B容器中再充入1mol CO2和1.5mol H2,投料比与原投料比相同,恒温恒压,故两者为等效平衡,故平衡混合气中CH3CH2OH的体积分数不变,
故答案为:不变
②打开K2,AB都是恒压环境,AB的体积共缩小了0.4aL,A与B体积相等,则A与B各缩小了0.2aL,则打开K2之前,B容器的体积为0.8aL,
故答案为:0.8a.
点评:本题考查化学平衡三段式计算,平衡标志的分析判断,恒温恒容容器,恒温恒压容器的分析判断是解题关键,气体压强之比和物质的量之比成正比例,题目难度较大.

练习册系列答案
相关题目
在进行“空气与人呼出的气体成分的差异研究”的下列做法或想法中,正确的是( )
| A、小红提出:呼出的气体水蒸气含量比空气中水蒸气含量少 |
| B、取用石灰水时,实验设计中未说明用量,小东取了1.5ml |
| C、亮亮认为在人呼出的气体中有一氧化碳 |
| D、小红认为人呼出的气体只有二氧化碳存在 |
已知一个氧分子的实际质量为a g,则阿伏加德罗常数可表示为( )
| A、a mol-1 | ||
B、
| ||
| C、32a mol-1 | ||
D、
|

 请根据如图所示实验过程和数据计算:
请根据如图所示实验过程和数据计算: