题目内容
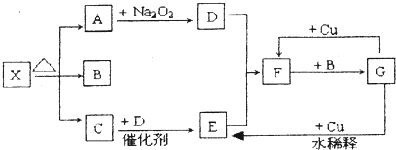
20.平达喜是一种常用抗酸药,其主要成分是由短周期元素组成的化合物X,式量为602.甲同学欲探究X的组成.查阅资料:
①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、碱式碳酸镁铝(或结晶水合物).
②Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.
实验过程:
Ⅰ.向一定量的X粉末中加入45.0 mL的2 mol/L盐酸溶液中,恰好完全反应并收集到112 mL(标准状况下)的A气体,A气体可使澄清石灰水变浑浊.
Ⅱ.用铂丝蘸取少量Ⅰ中所得的溶液,在火焰上灼烧,无黄色火焰.
Ⅲ.向Ⅰ中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤.
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.沉淀物进行洗涤干燥后重1.74 g.
(1)A的电子式是
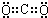 .
.(2)由Ⅰ中可确定X中存在两种带负电荷的原子团及个数比n(OH-):n(CO32-)=1.6:1.
(3)由Ⅰ判断X一定不含有的元素是Si.
(4)Ⅲ中生成B的离子方程式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(5)Ⅳ中B溶解的化学方程式是Al(OH)3+NaOH=NaAlO2+2H2O.
(6)沉淀C的化学式是Mg(OH)2.
(7)若X中n(B):n(C)=1:3,则X的化学式是Al2Mg6(OH)16CO3•4H2O.
分析 Ⅰ、气体A可使澄清石灰水变浑浊,结合抗酸药的有效成分,知该气体为CO2.根据标准状况下的体积可知其物质的量为;
X中一定不含Si,因为硅酸盐中加入过量盐酸,会产生硅酸沉淀,而题中给出Ⅰ中为溶液;
Ⅱ、X中一定不含Na,因为Na的焰色为黄色.
Ⅲ、根据题给信息知调节pH至5~6时生成的白色沉淀为Al(OH)3.
Ⅳ、加入过量NaOH溶液,沉淀B完全溶解,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O.
Ⅴ、加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀C为Mg(OH)2.以此可解答(1)(4)(5)(6)题;
(1)A为二氧化碳是碳原子分别和两个氧原子形成两对共用电子对形成的共价化合物;
(2)题目中盐酸的物质的量为:0.045L×2mol/L=0.09mol,二氧化碳的物质的量为:$\frac{112×1{0}^{-3}}{22.4mol/L}$=0.005mol,
Ⅰ中发生的反应为:H++OH-═H2O,CO32-+2H+═CO2↑+H2O,根据反应的量的关系可求的(2)题;
(3)X中一定不含Si,因为硅酸盐中加入过量盐酸,会产生硅酸沉淀;
(4)调节pH至5~6时生成的白色沉淀为Al(OH)3,NH3•H20为弱电解质,离子方程式中应写为化学式;
(5)Al(OH)3为两性氢氧化物,能溶于强碱,加入过量NaOH溶液,Al(OH)3沉淀完全溶解;
(6)根据“Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全;
(7)Mg(OH)2 的物质的量为$\frac{1.74g}{58g/mol}$=0.03mol,根据X中n(B):n(C)=1:3,则Al(OH)3 的物质的量为0.01mol,
则n(CO2):n[Al(OH)3]:n[Mg(OH)2]=0.005:0.01:0.03=1:2:6,则CO32-、Al3+、Mg2+的物质的量之比为1:2:6,结合电荷守恒,
则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:2:6:16,根据相对分子质量为602,可知1molX中含有4molH2O,可解答(7)题中的化学式.
解答 解:(1)气体A可使澄清石灰水变浑浊,结合抗酸药的有效成分,知该气体为CO2,为共价化合物,电子式为: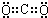 ,故答案为:
,故答案为: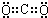 ;
;
(2)Ⅰ中发生的反应为:H++OH-═H2O,CO32-+2H+═CO2↑+H2O,盐酸的物质的量为:0.045L×2mol/L=0.09mol,二氧化碳的物质的量为:$\frac{112×1{0}^{-3}}{22.4mol/L}$=0.05mol,n(OH-)=0.09mol-0.005mol×2=0.08mol,所以:n(OH-):n(CO32-)=0.08mol:0.005mol=16:1,
故答案为:n(OH-):n(CO32-)=1.6:1.
(3)X中一定不含Si,因为硅酸盐中加入过量盐酸,会产生硅酸沉淀,而题中给出Ⅰ中为溶液,
故答案为:Si;
(4)调节pH至5~6时生成的白色沉淀为Al(OH)3,NH3•H20为弱电解质,离子方程式中应写为化学式,离子方程式为:Al3++3NH3•H20═Al(OH)3+↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(5)Al(OH)3为两性氢氧化物,能溶于强碱,加入过量NaOH溶液,Al(OH)3沉淀完全溶解,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(6)根据“Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全,”加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀C为Mg(OH)2,
故答案为:Mg(OH)2;
(7)已知:Mg(OH)2 的物质的量为$\frac{1.74g}{58g/mol}$=0.03mol,根据X中n(B):n(C)=1:3,则Al(OH)3 的物质的量为0.01mol,
则n(CO2):n[Al(OH)3]:n[Mg(OH)2]=0.005:0.01:0.03=1:2:6,则CO32-、Al3+、Mg2+的物质的量之比为1:2:6,结合电荷守恒,
则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:2:6:16,根据相对分子质量为602,可知1molX中含有4molH2O,所以X的化学式为Al2Mg6(OH)16CO3•4H2O,
故答案为:Al2Mg6(OH)16CO3•4H2O.
点评 本题考查平达喜药物成分的探究实验,题目较为综合,本题易错点为第(7)题,根据质量守恒定律解答,题目难度中等.

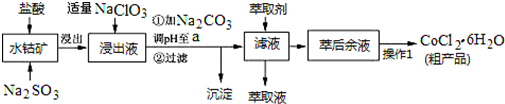
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
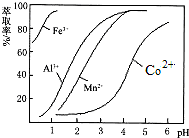
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
| A. | 可逆反应就是既能向正反应方向进行,又能向逆反应方向进行的化学反应 | |
| B. | 在催化剂的作用下,二氧化硫与氧气反应生成三氧化硫的同时,三氧化硫又分解生成二氧化硫和氧气,因此该反应是可逆反应 | |
| C. | 对于合成氨的反应,如果调控好反应条件,可使一种反应物的转化率达到100% | |
| D. | 碳酸钙在高温下分解生成氧化钙和二氧化碳,氧化钙和二氧化碳在常温下生成碳酸钙,因此这两个反应是可逆反应 |
(1)外观暗灰色,表皮光滑.
(2)在酒精灯上灼烧,火焰绿色;合金片熔化,但不滴落.
(3)取刮去表皮的金属,放入足量稀硫酸中,收集到标准状况下氢气9.96 L.
(4)另取刮去表皮的金属,放入足量氢氧化钠溶液中,也收集到标准状况下氢气9.96 L.
试据此判断,合金中含有的成分是( )
| A. | Cu、Fe | B. | K、Na | C. | Cu、Al | D. | Zn、Mg |
| A. | MgCl2 | B. | NaF | C. | MgO | D. | K2S |
| A. | K+、Br-、CO32-、OH- | B. | H+、Br-、ClO-、SO42-、Na+ | ||
| C. | SO42-、Br-、H+、Fe3+ | D. | Br-、SO32-、OH-、K+ |
 理论上任何自发的氧化还原反应都可以设计成原电池.现使用锌电极、铜电极、橙子(酸性介质)设计如图所示的水果电池.
理论上任何自发的氧化还原反应都可以设计成原电池.现使用锌电极、铜电极、橙子(酸性介质)设计如图所示的水果电池.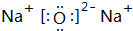 .
.