题目内容
9.下列除去杂质的方法不正确的是( )①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
分析 ①光照下乙烷发生取代反应;
②乙酸与饱和碳酸钠反应后,与乙酸乙酯分层;
③二者均与碳酸钠溶液反应;
④乙酸与CaO反应后,增大沸点差异.
解答 解:①光照下乙烷发生取代反应,不能除杂,应选溴水、洗气,故错误;
②乙酸与饱和碳酸钠反应后,与乙酸乙酯分层,然后分液可分离,故正确;
③二者均与碳酸钠溶液反应,不能除杂,应选饱和碳酸氢钠溶液,故错误;
④乙酸与CaO反应后,增大沸点差异,然后蒸馏可分离,故正确;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、发生的反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
相关题目
12.某实验小组同学模拟工业制碘的方法,探究ClO3-和I-的反应规律.实验操作及现象如下:
(1)取实验2后的溶液,进行如图1实验:
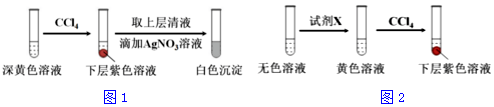
经检验,上述白色沉淀是AgCl.写出加入0.20mLNaClO3后,溶液中ClO3-和I-发生反应的离子方程式:
ClO3-+6I-+6H+=Cl-+3I2+3H2O.
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-.
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2.
进行实验:
①取少量实验4中的无色溶液进行如图2实验,进一步佐证其中含有IO3-.其中试剂X可以是c(填字母序号).
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是进一步佐证4中生成了Cl2.
获得结论:NaClO3溶液用量增加导致溶液褪色原因是2ClO3-+I2=Cl2↑+2IO3-(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
①对比实验4和5,可以获得的结论是ClO3-和I-的反应规律与H+(或H2SO4)的用量有关
②用离子方程式解释实验6的现象:6ClO3-+5I-+6H+=3Cl2↑+5IO3-+3H2O.
| 实验及试剂 | 编号 | 无色NaClO3溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
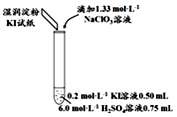 | 1 | 0.05mL | 浅黄色 | 无色 |
| 2 | 0.20mL | 深黄色 | 无色 | |
| 3 | 0.25mL | 浅黄色 | 蓝色 | |
| 4 | 0.30mL | 无色 | 蓝色 |

经检验,上述白色沉淀是AgCl.写出加入0.20mLNaClO3后,溶液中ClO3-和I-发生反应的离子方程式:
ClO3-+6I-+6H+=Cl-+3I2+3H2O.
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-.
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2.
进行实验:
①取少量实验4中的无色溶液进行如图2实验,进一步佐证其中含有IO3-.其中试剂X可以是c(填字母序号).
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是进一步佐证4中生成了Cl2.
获得结论:NaClO3溶液用量增加导致溶液褪色原因是2ClO3-+I2=Cl2↑+2IO3-(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
| 编号 | 6.0mol•L-1 H2SO4 溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 5 | 0.25mL | 浅黄色 | 无色 |
| 6 | 0.85mL | 无色 | 蓝色 |
②用离子方程式解释实验6的现象:6ClO3-+5I-+6H+=3Cl2↑+5IO3-+3H2O.
20.不能产生丁达尔效应的是( )
| A. | 豆浆 | B. | 淀粉溶液 | C. | Fe(OH)3胶体 | D. | 生理盐水 |
17.下列关于一些非金属元素与化合物的说法中,正确的是( )
| A. | 浓硝酸与铜会剧烈反应,浓硝酸起到了氧化剂和酸性的作用 | |
| B. | Cl2溶于水后可以漂白有色布条,且久置后布条可以恢复原色 | |
| C. | 铁遇冷的浓硫酸钝化,说明铁和冷的浓硫酸不会发生反应 | |
| D. | NaOH可与玻璃反应,所以可以用浓NaOH溶液在玻璃上作画 |
4.在下列反应中,盐酸既表现出酸性又表现出还原性的是( )
| A. | Zn2+HCl=ZnCl2+H2↑ | |
| B. | Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O | |
| C. | HCl+AgNO3=AgCl↓+HNO3 | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+H2O |
14.关于钠及其氧化物性质的叙述中,正确的是( )
| A. | Na能与CuSO4溶液反应置换出红色的铜 | |
| B. | Na2O是碱性氧化物,与酸反应生成盐和水 | |
| C. | Na2O和Na2O2都能与水反应,生成物完全相同 | |
| D. | Na2O2是白色固体,可用于呼吸面具中氧气的来源 |
1.下列电离方程式错误的是( )
| A. | H3PO4溶于水:H3PO4?3H++PO43- | |
| B. | (NH4)2SO4 溶于水:(NH4)2SO4═2NH4++SO42- | |
| C. | HF溶于水:HF?H++F- | |
| D. | NaHS溶于水:NaHS═Na++HS- HS-?H++S2- |
18.某烧杯中盛有含0.1mol (NH4)Al(SO4)2的溶液,现向其中缓缓加入2mol•L-1 NaOH溶液200mL,使其充分反应,此时烧杯中铝元素的存在形式为( )
| A. | Al3+和Al(OH)3 | B. | Al(OH)3 | C. | AlO2-和Al(OH)3 | D. | AlO2- |
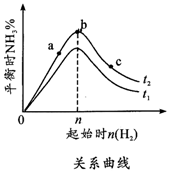 (1)在其他条件不变的情况下,起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g) $?_{△}^{催化剂}$2NH3(g)△H<0反应的影响可表示成如图所示的规律(图中t表示温度,n表示物质的量).
(1)在其他条件不变的情况下,起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g) $?_{△}^{催化剂}$2NH3(g)△H<0反应的影响可表示成如图所示的规律(图中t表示温度,n表示物质的量).