题目内容
6.下列不属于硅酸盐产品的是( )| A. | 陶瓷 | B. | 水泥 | C. | 玻璃 | D. | 光导纤维 |
分析 含有硅酸根离子的盐属于硅酸盐,传统硅酸盐产品包括:普通玻璃、陶瓷、水泥,据此解答.
解答 解:A.陶瓷主要成分是硅酸盐,属于硅酸盐材料,故A错误;
B.水泥主要成分是硅酸盐,属于硅酸盐材料,故B错误;
C.玻璃主要成分是硅酸盐,属于硅酸盐材料,故C错误;
D.光导纤维为二氧化硅,是氧化物不是硅酸盐,故D正确.
故选D.
点评 本题考查无机非金属材料中的硅酸盐产品,熟悉硅酸盐的定义是解题关键,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
7.在体积固定,容积为2L的密闭容器中进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应一定达到化学平衡状态的依据是BC.
A.容器中压强不再改变 B.混合气体中c(CO)不再改变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为
2mol/L,c(H2)为1.5mol/L,c(CO)为1mol/L,c(H2O)为3mol/L,则下一时刻,反应向逆向(填“正向”或“逆向”)进行.
(5)保持容器体积不变,下列措施中一定能使H2的转化率增大的有CD.
A.充入氦气
B.使用催化剂
C.平衡后再向容器内通入一定量CO2
D.升高温度
(6)在830℃时,发生上述反应,若开始时加入0.3mol CO2和0.2mol H2,经过3分钟刚好达到平衡,以CO的浓度变化表示的化学反应速率为v(CO)=0.02mol•L-1•min-1.
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应一定达到化学平衡状态的依据是BC.
A.容器中压强不再改变 B.混合气体中c(CO)不再改变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为
2mol/L,c(H2)为1.5mol/L,c(CO)为1mol/L,c(H2O)为3mol/L,则下一时刻,反应向逆向(填“正向”或“逆向”)进行.
(5)保持容器体积不变,下列措施中一定能使H2的转化率增大的有CD.
A.充入氦气
B.使用催化剂
C.平衡后再向容器内通入一定量CO2
D.升高温度
(6)在830℃时,发生上述反应,若开始时加入0.3mol CO2和0.2mol H2,经过3分钟刚好达到平衡,以CO的浓度变化表示的化学反应速率为v(CO)=0.02mol•L-1•min-1.
4.从香荚兰豆中提取的有机物A用来合成人工香料,其结构简式如图所示,下列关于物质A的说法正确的是( )
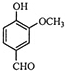

| A. | A的分子式是C8H10O3 | B. | A分子中含有酯基 | ||
| C. | A只能发生取代反应 | D. | A能与Na反应 |
1.(1)配制物质的量浓度为0.20mol•L-1NaOH溶液500mL,请回答下列问题(在横线上填上相应答案):
(2)在配制上述溶液时,下列哪个原因会造成所配溶液浓度偏高( )
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.称量时误用“左码右物”
| 应称量NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 4.0 | 500 | 烧杯、量筒、玻璃棒、药匙、托盘天平、胶头滴管 |
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.称量时误用“左码右物”
11.下列实验操作中,正确的是( )
| A. | 配制5% NaCl溶液时,将已准确称量的NaCl放入烧杯中并加适量的水搅拌溶解 | |
| B. | 配制1mol•L-1 Na0H溶液时,将溶解后的NaOH溶液立即注入容量瓶 | |
| C. | 配制0.1mol•L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 | |
| D. | 配制1mol•L-1 Na2CO3溶液500mL,将Na2CO3放在托盘天平右盘称量 |
18.NaCl在生产中有重要作用.
(1)某小组用NaCl进行以下实验:
①Ⅰ中白色沉淀的化学式是AgCl.
②Ⅱ中能说明沉淀变黑的离子方程式是2AgCl(s)+S2-(aq)=Ag2S(s)+2Cl-,沉淀能发生转化的主要原因是Ag2S比AgCl溶解度更小.
③经检测步骤Ⅲ中乳白色沉淀是AgCl和S的混合物.请写出黑色沉淀变为乳白色的化学方程式2Ag2S+O2+4NaCl+2H2O=4AgCl+2S+4NaOH,从化学平衡移动的角度解释在沉淀变色过程中NaCl的作用Ag2S被O2氧化生成S时释放出Ag+,NaCl中的Cl-与Ag+结合成AgCl沉淀,c(Ag+)减小,③中平衡向正反应方向移动,最终出现乳白色沉淀.
(2)电解法是治理铵盐为主要水体污染物的一种方法,原理是:在污水中加入一定量NaCl进行电解,产生的Cl2与水反应生成HClO,HClO 将NH4+氧化为N2,使水体脱氮.请写出酸性条件下HClO 与NH4+反应的离子方程式3HClO+2NH4+=N2↑+3Cl-+5H++3H2O.研究发现:污水呈弱酸性比强酸性更有利于使NH4+氧化为N2而脱氮,原因是酸性较强时,Cl2+H2O?H++Cl-+HClO 的化学平衡向逆反应方向移动,生成的HClO减少,不利脱氮.
(1)某小组用NaCl进行以下实验:
| 步 骤 | 现 象 |
| Ⅰ.将NaCl溶液与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.将Ⅱ中经过滤洗得到的黑色沉淀分成两份,在一份沉淀中加蒸馏水,另一份沉淀中加入NaCl溶液,同时浸泡较长时间. | 加蒸馏水的沉淀仍为黑色,加入NaCl溶液的沉淀变为乳白色 |
②Ⅱ中能说明沉淀变黑的离子方程式是2AgCl(s)+S2-(aq)=Ag2S(s)+2Cl-,沉淀能发生转化的主要原因是Ag2S比AgCl溶解度更小.
③经检测步骤Ⅲ中乳白色沉淀是AgCl和S的混合物.请写出黑色沉淀变为乳白色的化学方程式2Ag2S+O2+4NaCl+2H2O=4AgCl+2S+4NaOH,从化学平衡移动的角度解释在沉淀变色过程中NaCl的作用Ag2S被O2氧化生成S时释放出Ag+,NaCl中的Cl-与Ag+结合成AgCl沉淀,c(Ag+)减小,③中平衡向正反应方向移动,最终出现乳白色沉淀.
(2)电解法是治理铵盐为主要水体污染物的一种方法,原理是:在污水中加入一定量NaCl进行电解,产生的Cl2与水反应生成HClO,HClO 将NH4+氧化为N2,使水体脱氮.请写出酸性条件下HClO 与NH4+反应的离子方程式3HClO+2NH4+=N2↑+3Cl-+5H++3H2O.研究发现:污水呈弱酸性比强酸性更有利于使NH4+氧化为N2而脱氮,原因是酸性较强时,Cl2+H2O?H++Cl-+HClO 的化学平衡向逆反应方向移动,生成的HClO减少,不利脱氮.