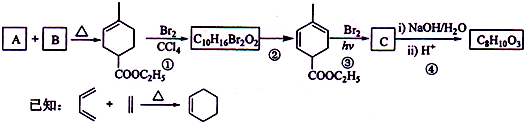
题目内容
 实验室要配制500mL 0.2mol/L NaOH溶液,请回答下列问题:
实验室要配制500mL 0.2mol/L NaOH溶液,请回答下列问题:(1)配制过程中不需要使用的化学仪器有
A.烧杯 B.500mL容量瓶 C.漏斗 D.胶头滴管
(2)用托盘天平称取氢氧化钠,其质量为
(3)下列主要操作步骤的正确顺序是
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1-2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到500mL 容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中.
(4)如果实验过程中缺少步骤⑤,会使配制出的NaOH溶液浓度
(5)实验两次用到玻璃棒,其作用分别是:
(6)试分析下列操作对所配溶液的浓度有何影响.(填“偏高”、“偏低”或“无影响”)
①定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,对所配溶液浓度的
影响
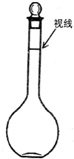
②某同学观察液面的情况如图所示,则所配置的溶液的浓度
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)配制一定物质的量浓度溶液时不用漏斗;
(2)根据n=cV,m=nM,求得氢氧化钠质量为4.0 g;
(3)配制一定物质的量浓度溶液时主要操作步骤的正确顺序为称量、溶解、冷却、转移、洗涤、定容,摇匀;
(4)缺少洗涤操作,会损失溶质,导致配制溶液的物质的量浓度偏低;
(5)溶解氢氧化钠时玻璃棒用来搅拌加速溶解,在转移溶液时是起到引流作用;
(6)依据C=
分析,凡是使n偏小或者使V偏大的操作都会使溶液的浓度偏小,反之,溶液浓度将偏大.
(2)根据n=cV,m=nM,求得氢氧化钠质量为4.0 g;
(3)配制一定物质的量浓度溶液时主要操作步骤的正确顺序为称量、溶解、冷却、转移、洗涤、定容,摇匀;
(4)缺少洗涤操作,会损失溶质,导致配制溶液的物质的量浓度偏低;
(5)溶解氢氧化钠时玻璃棒用来搅拌加速溶解,在转移溶液时是起到引流作用;
(6)依据C=
| n |
| V |
解答:
解:(1)溶液配制过程中需要烧杯溶解固体,需要500mL容量瓶配制溶液,需要胶头滴管定容,需要玻璃棒搅拌和引流,所以没有用到的是漏斗,故选C;
(2)m=CVM=0.2mol/L×0.5L×40g/mol=4.0g,故答案为:4.0;
(3)实验操作的步骤:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作进行排序,所以其排列顺序为:①③⑤②④,故答案为:①③⑤②④;
(4)未洗涤烧杯内壁和玻璃棒,溶质的物质的量减少,浓度偏低,故答案为:偏低;
(5)在溶解氢氧化钠时用玻璃棒搅拌可以加速固体溶解;容量瓶瓶颈太细,移液时用玻璃棒将溶液引流入容量瓶,故答案为:搅拌加速溶解、引流;
(6)①定容后,加盖倒转摇匀后,发现液面低于刻度线,不用再加水,否则引起浓度偏低,故答案为:偏低;
②定容时俯视刻度线,导致所加水减少,最终导致所配溶液的物质的量浓度偏高,故答案为:偏高.
(2)m=CVM=0.2mol/L×0.5L×40g/mol=4.0g,故答案为:4.0;
(3)实验操作的步骤:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作进行排序,所以其排列顺序为:①③⑤②④,故答案为:①③⑤②④;
(4)未洗涤烧杯内壁和玻璃棒,溶质的物质的量减少,浓度偏低,故答案为:偏低;
(5)在溶解氢氧化钠时用玻璃棒搅拌可以加速固体溶解;容量瓶瓶颈太细,移液时用玻璃棒将溶液引流入容量瓶,故答案为:搅拌加速溶解、引流;
(6)①定容后,加盖倒转摇匀后,发现液面低于刻度线,不用再加水,否则引起浓度偏低,故答案为:偏低;
②定容时俯视刻度线,导致所加水减少,最终导致所配溶液的物质的量浓度偏高,故答案为:偏高.
点评:本题考查了配置一定物质的量浓度溶液,题目难度不大,掌握配置溶液的步骤选择合适的仪器即可解答,注意误差分析的方法和技巧.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、2.3g金属钠变为Na+时失去的电子数为NA |
| B、18gH2O所含的原子数目为NA |
| C、常温下22.4L氢气所含的原子数目为2NA |
| D、100℃、1.01×105Pa 32gO2所含的分子数为NA |
下列四组实验,根据实验事实得出的结论,正确的是( )
| A、在某试液中滴加BaCl2溶液得白色沉淀,取该白色沉淀加稀硝酸不溶解--原未知试液中一定含有SO42- |
| B、某未知气体在空气中燃烧,其产物能使无水CuSO4变蓝色-原气体一定是H2 |
| C、在某未知试液中滴加盐酸产生无色气体,将该气体通入足量澄清石灰水中得白色沉淀--原未知试液中一定含有CO32- |
| D、在某未知试液中加入浓的NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体--原未知试液中一定含有NH4+ |