题目内容
(1)下列物质能导电的是 ,属于电解质的是 ,属于非电解质的是 ,属于强电解质的是 .(填序号)
①汞 ②液氨 ③CaCO3(s) ④熔融氢氧化钠 ⑤盐酸
⑥干冰 ⑦Cl2 ⑧液态醋酸 ⑨Al2O3(s) ⑩乙醇
(2)足量的Mg粉与一定量的稀硫酸反应,为了减缓反应速度,且不影响生成氢气的总量,可向稀硫酸中加入适量的
A.NaOH(s) B.H2O(l) C.CuSO4(s) D.CH3COONa(s) E.Na2SO4(aq) F.NaNO3(aq)
①汞 ②液氨 ③CaCO3(s) ④熔融氢氧化钠 ⑤盐酸
⑥干冰 ⑦Cl2 ⑧液态醋酸 ⑨Al2O3(s) ⑩乙醇
(2)足量的Mg粉与一定量的稀硫酸反应,为了减缓反应速度,且不影响生成氢气的总量,可向稀硫酸中加入适量的
A.NaOH(s) B.H2O(l) C.CuSO4(s) D.CH3COONa(s) E.Na2SO4(aq) F.NaNO3(aq)
考点:电解质与非电解质,化学反应速率的影响因素,强电解质和弱电解质的概念
专题:化学反应速率专题,电离平衡与溶液的pH专题
分析:(1)电解质是指:在水溶液中或熔融状态下能够导电的化合物;
非电解质是指:在水溶液里和熔融状态下都不导电的化合物;
强电解质是在水溶液中或熔融状态下能完全电离的电解质;
物质导电的条件:存在自由移动电子或者自由移动的离子;
(2)根据反应的实质为Mg+2H+═Mg2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,以此来解答.
非电解质是指:在水溶液里和熔融状态下都不导电的化合物;
强电解质是在水溶液中或熔融状态下能完全电离的电解质;
物质导电的条件:存在自由移动电子或者自由移动的离子;
(2)根据反应的实质为Mg+2H+═Mg2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,以此来解答.
解答:
解:(1)①汞存在自由移动电子,能够导电,是单质,所以既不是电解质又不是非电解质;
②液氨在水溶液里和熔融状态下自身不能电离产生自由移动的离子,是不导电的化合物,属于非电解质;
③CaCO3(s) 不存在自由移动电子或者自由移动的离子,不导电,在熔融状态下,能完全电离产生自由移动的离子而导电,属于强电解质;
④熔融氢氧化钠存在自由移动的离子,能够导电,属于强电解质;
⑤盐酸含有自由移动的离子,能导电,属于混合物既不是电解质又不是非电解质;
⑥干冰在水溶液里和熔融状态下自身不能电离产生自由移动的离子,是不导电的化合物,属于非电解质;
⑦Cl2不存在自由移动电子或者自由移动的离子,不导电,属于单质,既不是电解质又不是非电解质;
⑧液态醋酸不存在自由移动电子或者自由移动的离子,不导电,但是在水溶液中或熔融状态下能够导电,是化合物,所以是电解质,在水溶液中只能部分电离,属于弱电解质;
⑨Al2O3(s)不存在自由移动电子或者自由移动的离子,不导电,在熔融状态下能够导电,是化合物,所以属于电解质,在熔融状态下能够完全电离,属于强电解质;
⑩乙醇不存在自由移动电子或者自由移动的离子,不导电,在水溶液里和熔融状态下都不导电,是化合物,属于非电解质;
故答案为:①④⑤;③④⑧⑨;②⑥⑩;③④⑨;
(2)Mg+2H+═Mg2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量;
A.加NaOH(s),氢氧化钠与稀硫酸发生酸碱中和反应,消耗氢离子,产生氢气量减少,故A错误;
B.加H2O(l)稀释,溶液中氢离子的浓度减小但不能改变氢离子的物质的量,所以能够减缓反应速度,且不影响生成氢气的总量,故B正确;
C.加如CuSO4(s),CuSO4(s)与镁反应生成Cu,从而形成原电池加快反应速率,但H+离子的物质的量不变,不影响生成氢气的总量,故C错误;
D.加入CH3COONa生成弱酸,H+离子浓度降低,但H+离子的物质的量的不变,则不影响生成氢气的总量,故D正确;
E.加入Na2SO4溶液,相当于加入水,溶液体积增大,氢离子浓度降低,反应速率减小,但生成氢气的总量不变,故E正确;
F.加入NaNO3溶液,硝酸根离子在酸性条件下具有强氧化性,与锌反应生成NO气体,而不生成氢气,故F错误;
故选:BDE.
②液氨在水溶液里和熔融状态下自身不能电离产生自由移动的离子,是不导电的化合物,属于非电解质;
③CaCO3(s) 不存在自由移动电子或者自由移动的离子,不导电,在熔融状态下,能完全电离产生自由移动的离子而导电,属于强电解质;
④熔融氢氧化钠存在自由移动的离子,能够导电,属于强电解质;
⑤盐酸含有自由移动的离子,能导电,属于混合物既不是电解质又不是非电解质;
⑥干冰在水溶液里和熔融状态下自身不能电离产生自由移动的离子,是不导电的化合物,属于非电解质;
⑦Cl2不存在自由移动电子或者自由移动的离子,不导电,属于单质,既不是电解质又不是非电解质;
⑧液态醋酸不存在自由移动电子或者自由移动的离子,不导电,但是在水溶液中或熔融状态下能够导电,是化合物,所以是电解质,在水溶液中只能部分电离,属于弱电解质;
⑨Al2O3(s)不存在自由移动电子或者自由移动的离子,不导电,在熔融状态下能够导电,是化合物,所以属于电解质,在熔融状态下能够完全电离,属于强电解质;
⑩乙醇不存在自由移动电子或者自由移动的离子,不导电,在水溶液里和熔融状态下都不导电,是化合物,属于非电解质;
故答案为:①④⑤;③④⑧⑨;②⑥⑩;③④⑨;
(2)Mg+2H+═Mg2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量;
A.加NaOH(s),氢氧化钠与稀硫酸发生酸碱中和反应,消耗氢离子,产生氢气量减少,故A错误;
B.加H2O(l)稀释,溶液中氢离子的浓度减小但不能改变氢离子的物质的量,所以能够减缓反应速度,且不影响生成氢气的总量,故B正确;
C.加如CuSO4(s),CuSO4(s)与镁反应生成Cu,从而形成原电池加快反应速率,但H+离子的物质的量不变,不影响生成氢气的总量,故C错误;
D.加入CH3COONa生成弱酸,H+离子浓度降低,但H+离子的物质的量的不变,则不影响生成氢气的总量,故D正确;
E.加入Na2SO4溶液,相当于加入水,溶液体积增大,氢离子浓度降低,反应速率减小,但生成氢气的总量不变,故E正确;
F.加入NaNO3溶液,硝酸根离子在酸性条件下具有强氧化性,与锌反应生成NO气体,而不生成氢气,故F错误;
故选:BDE.
点评:本题考查了化学基本概念、影响反应速率的因素,题目难度不大,熟悉电解质、非电解质、强弱电解质的概念是解题关键,注意牢记影响反应速率的因素.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 某学习小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
某学习小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )| A、K与M、N均断开时,该装置中无反应发生 |
| B、K与M、N均断开时,Zn表面有Cu析出 |
| C、K与M相连时,电流由铜片流向锌片 |
| D、K与N相连时,铜片溶解,锌片质量增加 |
 如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?)?3Z(g).此时Ⅱ中X、Y、Z的物质的量之比为1:2:2,则下列说法一定正确的是( )
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?)?3Z(g).此时Ⅱ中X、Y、Z的物质的量之比为1:2:2,则下列说法一定正确的是( )| A、若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ |
| B、若X、Y不均为气态,到达平衡后若在Ⅰ中再加入1molZ,则新平衡时Y的体积分数变大 |
| C、若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ |
| D、若X、Y不均为气态,到平衡后若在Ⅱ中再加入2molZ,则新平衡时Z的体积分数变小 |
在Na2O2与水反应中,叙述正确的是( )
| A、O2是还原产物 |
| B、NaOH是氧化产物 |
| C、Na2O2是氧化剂,水是还原剂 |
| D、Na2O2中,-1价的氧既得电子,又失电子 |
金属钠在空气中放置,最终变为( )
| A、NaOH |
| B、Na2CO3 |
| C、NaHCO3 |
| D、Na2CO3?10H2O |

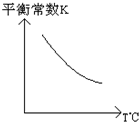 工业上利用反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=Q kJ?mol-1,制备H2.已知该反应的平衡常数K与温度的关系如图所示.若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:
工业上利用反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=Q kJ?mol-1,制备H2.已知该反应的平衡常数K与温度的关系如图所示.若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表: