题目内容
已知B、C为用途广泛的金属,H具有磁性氧化物,I是一种白色胶状沉淀,它们有如图所示的转化关系(部分产物未列出):
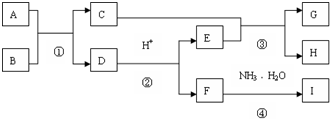
回答下列问题:
(1)E和G的化学式分别为 , .
(2)写出反应的化学方程式:① ③ .写出反应的离子方程式② ④ .

回答下列问题:
(1)E和G的化学式分别为
(2)写出反应的化学方程式:①
考点:无机物的推断,常见金属元素的单质及其化合物的综合应用
专题:推断题,几种重要的金属及其化合物
分析:已知B、C为用途广泛的金属,A+B=C+D,判断为铝热反应,B为Al,C为Fe,D为Al2O3,F为Al3+盐,I是一种白色胶状沉淀,为Al(OH)3,E为H2O,G为H2,H具有磁性氧化物,判断为Fe304,据此分析回答:
解答:
解:已知B、C为用途广泛的金属,A+B=C+D,判断为铝热反应,B为Al,C为Fe,D为Al2O3,F为Al3+盐,I是一种白色胶状沉淀,为Al(OH)3,E为H2O,G为H2,H具有磁性氧化物,判断为Fe304;
(1)分析可知E为H2O,G为H2;
故答案为:H2O、H2;
(2)反应①是铝和氧化铁发生的铝热反应,化学方程式为;2Al+Fe2O3
Al2O3+2Fe;反应③是铁和水蒸气反应生成四氧化三铁和氢气,化学方程式为:3Fe+4H2O
Fe3O4+4H2;反应②是氧化铝溶于酸反应生成铝盐和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O;反应④是铝盐和一水合氨反应生成氢氧化铝沉淀和铵盐,反应的离子方程式为:Al3++3NH4?H2O=Al(OH)3↓+3NH4+;
故答案为:2Al+Fe2O3
Al2O3+2Fe,3Fe+4H2O
Fe3O4+4H2,Al2O3+6H+=2Al3++3H2O,Al3++3NH4?H2O=Al(OH)3↓+3NH4+;
(1)分析可知E为H2O,G为H2;
故答案为:H2O、H2;
(2)反应①是铝和氧化铁发生的铝热反应,化学方程式为;2Al+Fe2O3
| ||
| ||
故答案为:2Al+Fe2O3
| ||
| ||
点评:本题考查了物质性质和转化关系的分析判断,主要是费用特征的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
普罗加比是目前临床上应用的主要抗癫痫药物之一,它可由A经多步反应合成. 
下列说法正确的是( )

下列说法正确的是( )
| A、物质A分子中在同一平面上的原子最多为12个 |
| B、1 mol中间体最多能与7 mol H2发生加成反应 |
| C、普罗加比可与Na2CO3溶液发生反应 |
| D、物质A、中间体和普罗加比都易溶于水 |
下列说法正确的是( )
A、钾(K)原子基态的原子结构示意图为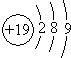 |
B、H2O电子式为 |
C、O的原子基态电子的轨道表示式为 |
| D、Ca2+离子基态电子排布式为1s22s22p63s23p64s2 |
对于可逆反应:mA(g)+nB(g)?pC(g)+qD(g);△H<0;已知m+n>p+q.若反应由A与B组成的混合物开始,并分别在下列情况下达到平衡:在100℃,1×106Pa时,A的转化率为α1;在200℃,1×106Pa时,A的转化率为α2;在100℃,1×107Pa时,A的转化率为α3;则α1,α2,α3之间的大小关系是( )
| A、α1>α2>α3 |
| B、α3>α2>α1 |
| C、α3>α1>α2 |
| D、α1>α3>α2 |
柠檬酸的结构简式如图,下列说法正确的是( )
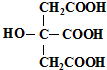
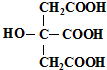
| A、柠檬酸中能发生酯化反应的官能团有2种 |
| B、1 mol柠檬酸可与4 mol NaOH发生中和反应 |
| C、1 mol柠檬酸与足量金属Na反应生成生成1.5mol H2 |
| D、柠檬酸与O2在Cu作催化剂,加热的条件下,能发生氧化反应 |
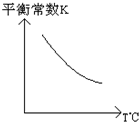 工业上利用反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=Q kJ?mol-1,制备H2.已知该反应的平衡常数K与温度的关系如图所示.若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:
工业上利用反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=Q kJ?mol-1,制备H2.已知该反应的平衡常数K与温度的关系如图所示.若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表: