题目内容
 Ⅰ某化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:取20.00mL0.2500mol/LH2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
Ⅰ某化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:取20.00mL0.2500mol/LH2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O记录数据如下:
| 滴定次数 | 标准溶液体积/mL | 待测溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20.00 | 1.50 | 23.70 |
| 2 | 20.00 | 1.02 | 21.03 |
| 3 | 20.00 | 2.00 | 21.99 |
(2)滴定终点的判断方法是:
(3)根据上述数据计算,该KMnO4溶液浓度为
(4)下列操作中使得KMnO4溶液浓度偏低的是
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定前盛放标准H2C2O4溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定管内滴定前有气泡,滴定后气泡消失
D.读取 KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数.
Ⅱ、某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如下方案:
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 | ||
| 浓度 (mol?L-1) | 体积 (mL) | 浓度 (mol?L-1) | 体积 (mL) | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(6)探究温度对化学反应速率影响的实验编号是
(7)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=
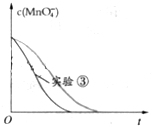
(8)已知实验③中c(MnO4-)~反应时间t的变化曲线如图.若保持其他条件不变,请在图中画出实验②中c(MnO4-)~t的变化曲线示意图.
考点:中和滴定,探究影响化学反应速率的因素
专题:实验题,实验设计题
分析:I、(1)KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中;
(2)草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为紫红色,红色30s内不褪去,说明滴定到终点;
(3)第1组KMnO4溶液的体积与第2、3组相差比较大,应按第2、3组的平均值为消耗KMnO4溶液的体积,根据关系式2KMnO4~5H2C2O4计算;
(4)由关系式2KMnO4~5H2C2O4可知,c(KMnO4)=
×
,据此分析判断;
Ⅱ、(5)根据题中信息及化合价升降法配平反应的化学方程式,然后根据电子守恒计算出1mol草酸完全反应转移的电子数;根据“观察到紫色褪去”必须满足高锰酸钾的物质的量小于草酸的物质的量解得二者浓度关系;
(6)根据探究温度对反应速率影响时除了温度外其它条件必须相同判断;根据体积浓度对反应速率影响时除了浓度不同,其他条件必须完全相同分析;
(7)先根据醋酸和高锰酸钾的物质的量判断过量,然后根据不足量及反应速率表达式计算出反应速率;
(8)根据温度降低反应速率减小画出25℃时c(MnO4-)~t的变化曲线示意图.
(2)草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为紫红色,红色30s内不褪去,说明滴定到终点;
(3)第1组KMnO4溶液的体积与第2、3组相差比较大,应按第2、3组的平均值为消耗KMnO4溶液的体积,根据关系式2KMnO4~5H2C2O4计算;
(4)由关系式2KMnO4~5H2C2O4可知,c(KMnO4)=
| V(H2C2O4)?c(H2C2O4) |
| V(KMnO4) |
| 2 |
| 5 |
Ⅱ、(5)根据题中信息及化合价升降法配平反应的化学方程式,然后根据电子守恒计算出1mol草酸完全反应转移的电子数;根据“观察到紫色褪去”必须满足高锰酸钾的物质的量小于草酸的物质的量解得二者浓度关系;
(6)根据探究温度对反应速率影响时除了温度外其它条件必须相同判断;根据体积浓度对反应速率影响时除了浓度不同,其他条件必须完全相同分析;
(7)先根据醋酸和高锰酸钾的物质的量判断过量,然后根据不足量及反应速率表达式计算出反应速率;
(8)根据温度降低反应速率减小画出25℃时c(MnO4-)~t的变化曲线示意图.
解答:
解:I、(1)KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中,故答案为:酸式;
(2)草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为紫红色,红色30s内不褪去,说明滴定到终点;
故答案为:加入最后一滴KMnO4溶液,溶液变为紫红色,且30s内红色不褪去;
(3)第1组KMnO4溶液的体积与第2、3组相差比较大,应舍掉,应按第2、3组计算消耗KMnO4溶液的体积,故消耗KMnO4溶液的体积为
=20mL,令KMnO4溶液的浓度为cmol/L,由2KMnO4~5H2C2O4可知:20mL×cmol/L=
×20mL×0.250mol/L,解得c=0.100;
故答案为:0.100;
(4)A.滴定管用水洗净后直接注入KMnO4溶液,高锰酸钾溶液被稀释,使用的高锰酸钾溶液的体积偏大,测定的高锰酸钾的浓度偏低,故A符合;
B.锥形瓶用蒸馏水洗净后没有干燥,对草酸的物质的量没有影响,故对测定的高锰酸钾的浓度无影响,故B不符合;
C.滴定管内在滴定前有气泡,滴定后气泡消失,导致酸性高锰酸钾溶液的体积读数偏大,测定的高锰酸钾的浓度偏低,故C符合;
D.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数,导致酸性高锰酸钾溶液的体积读数偏小,测定的高锰酸钾的浓度偏高,故D不符合;
故选AC;
Ⅱ、(5)根据反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,利用化合价升降相等写出反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑;H2C2O4中碳元素的化合价为+3价,变成二氧化碳后化合价总共升高了2(4-3)价,所以每消耗1mol H2C2O4转移2mol电子;为了观察到紫色褪去,高锰酸钾的物质的量应该少量,即n(H2C2O4):n(KMnO4)≥
=2.5,
故答案为:2; 2.5;
(6)探究温度对化学反应速率影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验编号是:②和③;探究反应物浓度对化学反应速率影响,除了浓度不同,其他条件完全相同的实验编号是①和②,
故答案为:②和③; ①和②;
(7)草酸的物质的量为:0.10mol?L-1×0.002L=0.0002mol,高锰酸钾的物质的量为:0.010mol?L-1×0.004L=0.00004mol,草酸和高锰酸钾的物质的量之比为:0.0002mol:0.00004mol=5:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:
=
×0.010mol/L,
这段时间内平均反应速率v(KMnO4)=
=0.010mol?L-1?min-1,
故答案为:0.010或1.0×10-2;
(8)25℃时反应速率小于50℃时,所以高锰酸根离子的浓度变化比50℃时小,反应需要的时间大于50℃条件下需要的时间,据此画出25℃时c(MnO4-)~t的变化曲线示意图为: ,故答案为:
,故答案为: .
.
(2)草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为紫红色,红色30s内不褪去,说明滴定到终点;
故答案为:加入最后一滴KMnO4溶液,溶液变为紫红色,且30s内红色不褪去;
(3)第1组KMnO4溶液的体积与第2、3组相差比较大,应舍掉,应按第2、3组计算消耗KMnO4溶液的体积,故消耗KMnO4溶液的体积为
| (21.03-1.02)mL+(21.99-2.00)mL |
| 2 |
| 2 |
| 5 |
故答案为:0.100;
(4)A.滴定管用水洗净后直接注入KMnO4溶液,高锰酸钾溶液被稀释,使用的高锰酸钾溶液的体积偏大,测定的高锰酸钾的浓度偏低,故A符合;
B.锥形瓶用蒸馏水洗净后没有干燥,对草酸的物质的量没有影响,故对测定的高锰酸钾的浓度无影响,故B不符合;
C.滴定管内在滴定前有气泡,滴定后气泡消失,导致酸性高锰酸钾溶液的体积读数偏大,测定的高锰酸钾的浓度偏低,故C符合;
D.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数,导致酸性高锰酸钾溶液的体积读数偏小,测定的高锰酸钾的浓度偏高,故D不符合;
故选AC;
Ⅱ、(5)根据反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,利用化合价升降相等写出反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑;H2C2O4中碳元素的化合价为+3价,变成二氧化碳后化合价总共升高了2(4-3)价,所以每消耗1mol H2C2O4转移2mol电子;为了观察到紫色褪去,高锰酸钾的物质的量应该少量,即n(H2C2O4):n(KMnO4)≥
| 5 |
| 2 |
故答案为:2; 2.5;
(6)探究温度对化学反应速率影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验编号是:②和③;探究反应物浓度对化学反应速率影响,除了浓度不同,其他条件完全相同的实验编号是①和②,
故答案为:②和③; ①和②;
(7)草酸的物质的量为:0.10mol?L-1×0.002L=0.0002mol,高锰酸钾的物质的量为:0.010mol?L-1×0.004L=0.00004mol,草酸和高锰酸钾的物质的量之比为:0.0002mol:0.00004mol=5:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:
| 0.010mol/L×0.004L |
| 0.002L+0.004L |
| 2 |
| 3 |
这段时间内平均反应速率v(KMnO4)=
| ||
|
故答案为:0.010或1.0×10-2;
(8)25℃时反应速率小于50℃时,所以高锰酸根离子的浓度变化比50℃时小,反应需要的时间大于50℃条件下需要的时间,据此画出25℃时c(MnO4-)~t的变化曲线示意图为:
 ,故答案为:
,故答案为: .
.
点评:本题考查氧化还原滴定原理与应用、探究影响速率的因素、对实验数据的处理等,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具备扎实的基础知识与运用知识分析问题、解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
不用其他试剂,只用试管和胶头滴管无法鉴别的溶液是( )
| A、Al2(SO4)3和氨水 |
| B、Na2CO3和稀盐酸 |
| C、NaCl和AgNO3 |
| D、盐酸和NaAlO2 |
若甲烷与氯气以物质的量之比1:1混合,在光照下得到的产物:①CH3Cl,②CH2Cl2,③CHCl3,④CCl4,其中正确的是( )
| A、只有① |
| B、只有③ |
| C、①②③的混合物 |
| D、①②③④的混合物 |

 现有1mol某烯烃分子被酸性高锰酸钾溶液氧化后得到2molCO2,和
现有1mol某烯烃分子被酸性高锰酸钾溶液氧化后得到2molCO2,和 请写出该烯烃分子发生加聚反应的化学方程式
请写出该烯烃分子发生加聚反应的化学方程式