题目内容
17.下列关于有机物结构、性质的说法正确的是( )| A. | 石油的分馏、裂化和煤的气化、液化、干馏都是化学变化 | |
| B. | 乙烯和苯都能与H2发生加成反应,说明二者分子中所含碳碳键相同 | |
| C. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 | |
| D. | 淀粉、油脂、蛋白质都能发生水解反应,都属于天然有机高分子化合物 |
分析 A.石油的分馏为物理变化;
B.苯不含碳碳双键;
C.烷烃、苯及其同系物、醇、羧酸和酯类都能发生取代反应;
D.油脂不是高分子化合物.
解答 解:A.石油的分馏根据物质的沸点进行分离,为物理变化,故A错误;
B.苯不含碳碳双键,故B错误;
C.在一定条件下,烷烃、苯及其同系物、醇、羧酸和酯类都能发生取代反应,注意酯类的水解反应属于取代反应,故C正确;
D.高分子化合物的相对分子质量一般在10000以上,油脂不是高分子化合物,故D错误.
故选C.
点评 本题综合考查有机物的结构和性质,为历年高考常见题型和高频考点,题目多角度考查物质的组成、结构、官能团的性质等知识,有利于学生良好科学素养的培养,难度不大.

练习册系列答案
相关题目
7.设NA为阿伏加德罗常数的值.下列说法中正确的是( )
| A. | 65g锌与足量稀硫酸反应产生的气体体积为22.4L | |
| B. | 标准状况下,以任意比混合的H2和CO气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA | |
| C. | 0.2mol H2O2在MnO2催化下充分反应生成O2的数目为0.2NA | |
| D. | 同温同压下,1mol H2在空气中充分燃烧,消耗O2的体积为22.4L |
8.某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子.某小组在实验室中用浸出萃取法制备硫酸铜:

(1)操作Ⅰ为过滤.操作Ⅱ用到的玻璃仪器有烧杯、分液漏斗.
(2)操作Ⅱ、操作Ⅲ的主要目的是除杂、富集铜元素.
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液.多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4.
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80℃、200℃、300℃.
设计实验检验悬浊液成分,完成表中内容.
限选试剂:2mol•L-1 HCl、1mol•L-1 H2SO4、0.1mol•L-1 NaOH、0.1mol•L-1BaCl2、蒸馏水.仪器和用品自选.
(4)上述实验需要100mL0.5 mol•L-1的CuSO4溶液,配制时需称取12.5g CuSO4•5H2O(化学式量:250).

(1)操作Ⅰ为过滤.操作Ⅱ用到的玻璃仪器有烧杯、分液漏斗.
(2)操作Ⅱ、操作Ⅲ的主要目的是除杂、富集铜元素.
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液.多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4.
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80℃、200℃、300℃.
设计实验检验悬浊液成分,完成表中内容.
限选试剂:2mol•L-1 HCl、1mol•L-1 H2SO4、0.1mol•L-1 NaOH、0.1mol•L-1BaCl2、蒸馏水.仪器和用品自选.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,:加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液 | 有白色沉淀生成说明悬浊液中混有Cu4(OH)6SO4. |
| 步骤2:另取少量悬浊液于试管中,将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察 | 试管中有黑色固体生成,说明悬浊液中混有Cu(OH)2. |
5.一定条件下反应2AB(g)?A2(g)+B2(g)达到化学平衡,有关说法正确的是( )
| A. | 达到化学平衡时,AB将完全分解 | |
| B. | 达到化学平衡时,AB、A2、B2的物质的量浓度比一定为2:1:1 | |
| C. | 达到化学平衡时,AB、A2、B2 的浓度一定不再变化 | |
| D. | 达到化学平衡时,正、逆反应速率相等且为0 |
2.将一定质量的镁铜合金加入到100mL某浓度HNO3溶液中,两者恰好反应,假设反应的还原产物只有NO气体,向所得溶液中加入物质的量浓度为3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
| A. | 加入合金的质量不可能为6.6g | |
| B. | 参加反应的硝酸的物质的量浓度为1mol/L | |
| C. | 生成沉淀完全时消耗NaOH溶液的体积为100 mL | |
| D. | 生成NO气体体积为2.24 L |
7.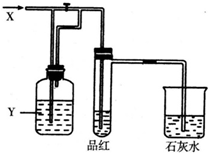 如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )
如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )
 如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )
如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )| ① | ② | ③ | ④ | |
| X | SO2 | H2S | CO2 | Cl2 |
| Y | 饱和的NaHCO3溶液 | 浓硫酸 | Na2SO3溶液 | Na2CO3溶液 |
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |