题目内容
5.一定条件下反应2AB(g)?A2(g)+B2(g)达到化学平衡,有关说法正确的是( )| A. | 达到化学平衡时,AB将完全分解 | |
| B. | 达到化学平衡时,AB、A2、B2的物质的量浓度比一定为2:1:1 | |
| C. | 达到化学平衡时,AB、A2、B2 的浓度一定不再变化 | |
| D. | 达到化学平衡时,正、逆反应速率相等且为0 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、达到化学平衡时,可逆反应AB不可能完全分解,故A错误;
B、当体系达平衡状态时,AB、A2、B2的物质的量浓度比可能为2:1:1,也可能不是2:1:1,与各物质的初始浓度及转化率有关,故B错误;
C、AB、A2、B2 的浓度一定不再变化,说明各物质的量不变,反应达到化学平衡,故C正确;
D、化学平衡是动态平衡,正、逆反应速率相等大于0,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
15.碳酸二甲酯(DMC)是一种无毒、环保性能优异、用途广泛的化工原料.在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:C02+2CH3OH→CO(OCH3)2+H2O.某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON ) 的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是( )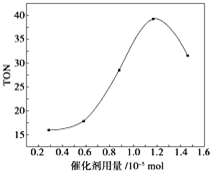

| A. | 由甲醇和CO2直接合成碳酸二甲酯,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义 | |
| B. | 在反应体系中添加合适的吸水剂,将提高该反应的TON | |
| C. | 当催化剂用量为1.2×10-5mol时,该反应的TON 达到最高点 | |
| D. | 当催化剂用量高于1.2×10-5mol时,随着催化剂用量的增加,甲醇的平衡转化率逐渐降低 |
16.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH下列叙述正确的是( )
| A. | 放电时每转移3mol电子,正极有1molK2FeO4被氧化 | |
| B. | 放电时负极反应为Zn+2e-+2OH-═Zn(OH)2 | |
| C. | 充电时阳极反应为Fe(OH)3-3e-+5OH-═FeO42-+4H2O | |
| D. | 放电时正极附近溶液的碱性减弱 |
20.下列仪器中,可在酒精灯上直接加热的是( )
| A. |  | B. |  | C. |  | D. |  |
10.如果25℃时,Kw=1.0×10-14,100℃下Kw=1.0×10-12.下列说法错误的是( )
| A. | 100℃下水的电离程度较大 | B. | 前者的C(H+)较后者小 | ||
| C. | 水的电离过程是一个放热过程 | D. | 温度越高,Kw越大 |
17.下列关于有机物结构、性质的说法正确的是( )
| A. | 石油的分馏、裂化和煤的气化、液化、干馏都是化学变化 | |
| B. | 乙烯和苯都能与H2发生加成反应,说明二者分子中所含碳碳键相同 | |
| C. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 | |
| D. | 淀粉、油脂、蛋白质都能发生水解反应,都属于天然有机高分子化合物 |
14.将足量NO2通入下列各溶液中,所含离子还能大量共存的是( )
| A. | Fe2+、CH3COO-、Na+、SO42 | B. | K+、Ca2+、HCO3-、Cl- | ||
| C. | Al3+、NH4+、Cl-、NO2 | D. | K+、Na+、SiO32、AlO2- |
15.下列叙述正确的是( )
| A. | 久置在空气中的NaOH溶液,加盐酸时有气体产生 | |
| B. | 50 mL 12 mol•L-1的浓盐酸与足量的MnO2反应,生成0.15 mol Cl2 | |
| C. | 在常温下,浓H2SO4不与Cu反应,是因为铜被钝化 | |
| D. | CO2通入浓的CaCl2溶液中产生白色沉淀 |