题目内容
7.设NA为阿伏加德罗常数的值.下列说法中正确的是( )| A. | 65g锌与足量稀硫酸反应产生的气体体积为22.4L | |
| B. | 标准状况下,以任意比混合的H2和CO气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA | |
| C. | 0.2mol H2O2在MnO2催化下充分反应生成O2的数目为0.2NA | |
| D. | 同温同压下,1mol H2在空气中充分燃烧,消耗O2的体积为22.4L |
分析 A.气体状况未知;
B.根据n=$\frac{V}{Vm}$=$\frac{N}{{N}_{A}}$结合反应的关系判断;
C.依据方程式2H2O2$\frac{\underline{MnO_2}}{△}$2H2O+O2↑计算;
D.气体状况未知.
解答 解:A.气体状况未知,无法计算产生氢气的体积,故A错误;
B.氢气和一氧化碳气体的物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,根据2CO~O2,2H2~O2,可知共消耗O20.2mol,分子数为0.2NA,故B正确;
C.依据方程式2H2O2$\frac{\underline{MnO_2}}{△}$2H2O+O2↑,0.2 mol H2O2生成O2的数目为0.1NA,故C错误;
D.气体状况未知,无法确定消耗氧气的体积,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数,题目难度中等,明确气体摩尔体积使用条件是解题关键,题目难不大.

练习册系列答案
相关题目
18. X、Y、Z、W 均为中学化学中常见物质或其溶液,一定条件下它们之间有如下转化关系(其它产物已略去),下列说法不正确的是( )
X、Y、Z、W 均为中学化学中常见物质或其溶液,一定条件下它们之间有如下转化关系(其它产物已略去),下列说法不正确的是( )
 X、Y、Z、W 均为中学化学中常见物质或其溶液,一定条件下它们之间有如下转化关系(其它产物已略去),下列说法不正确的是( )
X、Y、Z、W 均为中学化学中常见物质或其溶液,一定条件下它们之间有如下转化关系(其它产物已略去),下列说法不正确的是( )| A. | 若 W 是单质铁,则 Z 溶液可能是 FeCl2 溶液 | |
| B. | 若 X 是碳酸钠,则 W 可能是盐酸 | |
| C. | 若 W 是氢氧化钠,则 X 与 Z 可反应生成 Y | |
| D. | 若 W 为氧气,则 Z 与水反应(或溶于水)一定生成一种强酸 |
15.碳酸二甲酯(DMC)是一种无毒、环保性能优异、用途广泛的化工原料.在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:C02+2CH3OH→CO(OCH3)2+H2O.某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON ) 的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是( )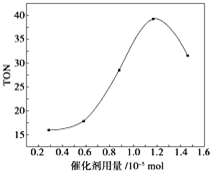

| A. | 由甲醇和CO2直接合成碳酸二甲酯,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义 | |
| B. | 在反应体系中添加合适的吸水剂,将提高该反应的TON | |
| C. | 当催化剂用量为1.2×10-5mol时,该反应的TON 达到最高点 | |
| D. | 当催化剂用量高于1.2×10-5mol时,随着催化剂用量的增加,甲醇的平衡转化率逐渐降低 |
2. 某化学小组进行Na2SO3的性质实验探究.
某化学小组进行Na2SO3的性质实验探究.
(1)在白色点滴板的a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加图所示的试剂:
实验现象如下表:
根据实验现象进行分析:
①a中实验现象证明Na2SO3具有还原性性.
②b中发生反应的离子方程式是SO32-+2S2-+6H+=3S↓+3H2O.
③应用化学平衡原理解释c中现象(用化学用语及简单文字表述)在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O?HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-═BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去
(2)在用NaOH溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH随n(SO${\;}_{3}^{2-}$):n(HSO${\;}_{3}^{-}$)变化关系如下表:
①当吸收液中n(SO32-):n(HSO3-)=10:1 时,溶液中离子浓度关系正确的是AC(填字母).
A.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)>c(H+)
C.c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②若n(SO32-):n(HSO3-)=3:2,则0.8mol NaOH溶液吸收了标准状况下的SO211.2 L.
 某化学小组进行Na2SO3的性质实验探究.
某化学小组进行Na2SO3的性质实验探究.(1)在白色点滴板的a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加图所示的试剂:
实验现象如下表:
| 编号 | 实验现象 |
| a | 溴水褪色 |
| b | 产生淡黄色沉淀 |
| c | 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
①a中实验现象证明Na2SO3具有还原性性.
②b中发生反应的离子方程式是SO32-+2S2-+6H+=3S↓+3H2O.
③应用化学平衡原理解释c中现象(用化学用语及简单文字表述)在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O?HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-═BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去
(2)在用NaOH溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH随n(SO${\;}_{3}^{2-}$):n(HSO${\;}_{3}^{-}$)变化关系如下表:
| n(SO${\;}_{3}^{2-}$ ):n(HSO${\;}_{3}^{-}$) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
A.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)>c(H+)
C.c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②若n(SO32-):n(HSO3-)=3:2,则0.8mol NaOH溶液吸收了标准状况下的SO211.2 L.
16.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH下列叙述正确的是( )
| A. | 放电时每转移3mol电子,正极有1molK2FeO4被氧化 | |
| B. | 放电时负极反应为Zn+2e-+2OH-═Zn(OH)2 | |
| C. | 充电时阳极反应为Fe(OH)3-3e-+5OH-═FeO42-+4H2O | |
| D. | 放电时正极附近溶液的碱性减弱 |
17.下列关于有机物结构、性质的说法正确的是( )
| A. | 石油的分馏、裂化和煤的气化、液化、干馏都是化学变化 | |
| B. | 乙烯和苯都能与H2发生加成反应,说明二者分子中所含碳碳键相同 | |
| C. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 | |
| D. | 淀粉、油脂、蛋白质都能发生水解反应,都属于天然有机高分子化合物 |
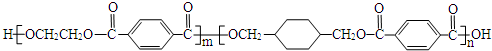
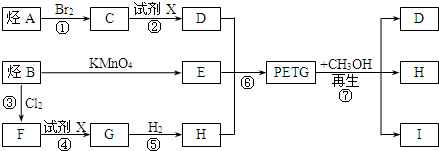
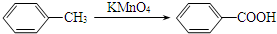
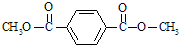 .
. .
.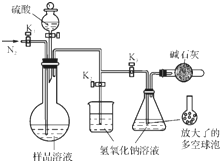 碳酸钠-过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:
碳酸钠-过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下: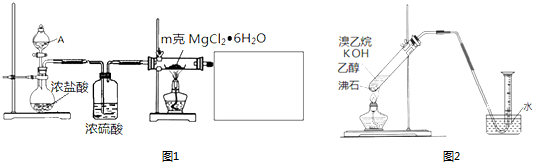
 .
.