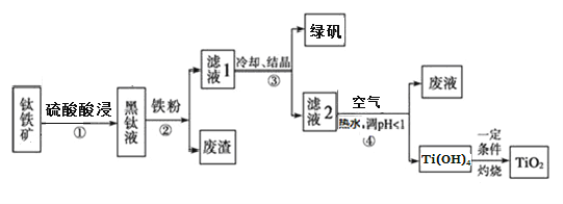
题目内容
【题目】大量的__________和__________扩散到大气中,被雨水吸收,当雨水的pH小于________时就形成了酸雨。根据形成酸雨的主要物质可将其分为硫酸型酸雨和硝酸型酸雨。 我国酸雨危害十分严重,是世界三大酸雨区之一,且主要为硫酸型酸雨。形成硫酸型酸雨主要是由于空气中二氧化硫含量超标。形成硫酸型酸雨发生的主要反应的化学方程式为
途径一:___________________________________、___________________________________;
途径二:___________________________________、___________________________________。
某校科技活动小组的同学们采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 | 48h后 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
根据上述材料回答下列问题:
酸雨放置时,pH发生变化的主要原因为_____________。
下列物品中,最易被酸雨腐蚀的是____________
A 铜制塑像 B 大理石雕刻 C 水泥路面 D 铝制窗框
【答案】SO2 氮的氧化物 5.6 SO2+H2OH2SO3 2H2SO3+O2=2H2SO4 ![]() SO3+H2O=H2SO4 酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强; B
SO3+H2O=H2SO4 酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强; B
【解析】
pH<5.6的雨水为酸雨,SO2和氮的氧化物在大气中,在空气、阳光等作用下发生一系列变化,遇雨时被雨水吸收形成酸雨。故答案为:SO2;氮的氧化物;5.6;
途径一:二氧化硫与雨水反应生成亚硫酸,亚硫酸被空气中的氧气氧化成硫酸,故答案为:SO2+H2OH2SO3;2H2SO3+O2=2H2SO4 ;
途径二:空气中的二氧化硫气体在粉尘做催化剂的条件下生成三氧化硫,三氧化硫再与雨水形成酸雨,故答案为:![]() ;SO3+H2O=H2SO4;
;SO3+H2O=H2SO4;
酸雨形成的主要原因是:大量燃烧化石燃料(煤和石油等),产生二氧化硫,随雨降落形成,酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强,故答案为:酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强;
A.铜的活泼性较差不和稀硫酸反应;B大理石雕刻主要成分是碳酸钙,易与稀硫酸反应;C 水泥路面属于硅酸盐产品,能被酸雨腐蚀,但不如大理石易被腐蚀;D铝制窗框含有的金属铝能与酸反应,但铝表面的氧化膜有保护作用;故答案为B。