题目内容
下表是元素周期表的一部分,用元素符号或化学式回答下列问题:
(1)在这些元素中 是最活泼的金属元素;其氢氧化物具有两性的元素是
(2)这些元素的最高价氧化物对应的水化物中酸性最强的物质的化学式
(3)从⑤到⑩元素中 原子半径最小.
(4)最不活泼的元素的单质的化学式是 .若该元素某核素原子核内中子数与质子数相等,则该核素的摩尔质量是
(5)用电子式表示⑩、⑥两元素形成化合物的过程
(6)与元素⑨非金属性强弱最接近的元素是
(7)试比较H2O 和NH3中共价键共用电子对的偏移程度:O-H N-H
(8)已知离子键的实质是电性作用.请比较Na2O、MgO的熔点:Na2O MgO
(9)根据下表判断:最接近磷原子半径R(10-10m)的取值范围的是
主族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)这些元素的最高价氧化物对应的水化物中酸性最强的物质的化学式
(3)从⑤到⑩元素中
(4)最不活泼的元素的单质的化学式是
(5)用电子式表示⑩、⑥两元素形成化合物的过程
(6)与元素⑨非金属性强弱最接近的元素是
(7)试比较H2O 和NH3中共价键共用电子对的偏移程度:O-H
(8)已知离子键的实质是电性作用.请比较Na2O、MgO的熔点:Na2O
(9)根据下表判断:最接近磷原子半径R(10-10m)的取值范围的是
| 元 素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是He、N、O、F、Na、Mg、Al、P、S、Cl元素,
(1)在这些元素中最活泼的金属元素位于周期表左下角;氢氧化铝呈两性;
(2)元素的非金属性越强,其最高价氧化物对应的水化物酸性越强;
(3)原子的电子层数越少其原子半径越小,同一周期元素,原子半径随着原子序数增大而减小;
(4)最不活泼的元素是稀有气体,若该元素某核素原子核内中子数与质子数相等,其质量数=质子数+中子数,其摩尔质量在数值上等于其质量数;
(5)⑩是Cl元素、⑥是Mg元素,两元素形成离子化合物氯化镁;
(6)处于对角线上的两种元素性质相似;
(7)元素的非金属性越强,其吸引电子的能力越强;
(8)离子晶体的熔沸点与其晶格能成正比,晶格能与离子半径成反比、与电荷成正比;
(9)同一周期元素,原子半径随着原子序数增大而减小,同一主族元素,原子半径随着原子序数增大而增大.
(1)在这些元素中最活泼的金属元素位于周期表左下角;氢氧化铝呈两性;
(2)元素的非金属性越强,其最高价氧化物对应的水化物酸性越强;
(3)原子的电子层数越少其原子半径越小,同一周期元素,原子半径随着原子序数增大而减小;
(4)最不活泼的元素是稀有气体,若该元素某核素原子核内中子数与质子数相等,其质量数=质子数+中子数,其摩尔质量在数值上等于其质量数;
(5)⑩是Cl元素、⑥是Mg元素,两元素形成离子化合物氯化镁;
(6)处于对角线上的两种元素性质相似;
(7)元素的非金属性越强,其吸引电子的能力越强;
(8)离子晶体的熔沸点与其晶格能成正比,晶格能与离子半径成反比、与电荷成正比;
(9)同一周期元素,原子半径随着原子序数增大而减小,同一主族元素,原子半径随着原子序数增大而增大.
解答:
解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是He、N、O、F、Na、Mg、Al、P、S、Cl元素,
(1)在这些元素中最活泼的金属元素位于周期表左下角为Na元素;氢氧化铝呈两性,所以氢氧化物呈两性的元素是Al,故答案为:Na;Al;
(2)元素的非金属性越强,其最高价氧化物对应的水化物酸性越强,这几种元素中非金属性最强的是Cl元素,其最高价氧化物的水化物酸性最强的是HClO4,故答案为:HClO4;
(3)原子的电子层数越少其原子半径越小,同一周期元素,原子半径随着原子序数增大而减小,所以这几种元素中原子半径最小的是Cl元素,故答案为:Cl;
(4)最不活泼的元素是稀有气体He,若该元素某核素原子核内中子数与质子数相等,其质量数=质子数+中子数=2+2=4,其摩尔质量在数值上等于其质量数,所以其摩尔质量为4g/mol,故答案为:4g/mol;
(5)⑩是Cl元素、⑥是Mg元素,两元素形成离子化合物氯化镁,其形成过程为 ,
,
故答案为: ;
;
(6)处于对角线上的两种元素性质相似,所以与S非金属性相似的是N元素,故答案为:N;
(7)元素的非金属性越强,其吸引电子的能力越强,非金属性O>N,所以H2O 和NH3中共价键共用电子对的偏移程度:O-H>N-H,故答案为:>;
(8)离子晶体的熔沸点与其晶格能成正比,晶格能与离子半径成反比、与电荷成正比,钠离子半径大于镁离子、钠离子电荷小于镁离子,所以熔点:Na2O<MgO,故答案为:<;
(9)同一周期元素,原子半径随着原子序数增大而减小,同一主族元素,原子半径随着原子序数增大而增大,则磷原子半径取值范围为1.02<R<1.17,故答案为:1.02<R<1.17.
(1)在这些元素中最活泼的金属元素位于周期表左下角为Na元素;氢氧化铝呈两性,所以氢氧化物呈两性的元素是Al,故答案为:Na;Al;
(2)元素的非金属性越强,其最高价氧化物对应的水化物酸性越强,这几种元素中非金属性最强的是Cl元素,其最高价氧化物的水化物酸性最强的是HClO4,故答案为:HClO4;
(3)原子的电子层数越少其原子半径越小,同一周期元素,原子半径随着原子序数增大而减小,所以这几种元素中原子半径最小的是Cl元素,故答案为:Cl;
(4)最不活泼的元素是稀有气体He,若该元素某核素原子核内中子数与质子数相等,其质量数=质子数+中子数=2+2=4,其摩尔质量在数值上等于其质量数,所以其摩尔质量为4g/mol,故答案为:4g/mol;
(5)⑩是Cl元素、⑥是Mg元素,两元素形成离子化合物氯化镁,其形成过程为
 ,
,故答案为:
 ;
;(6)处于对角线上的两种元素性质相似,所以与S非金属性相似的是N元素,故答案为:N;
(7)元素的非金属性越强,其吸引电子的能力越强,非金属性O>N,所以H2O 和NH3中共价键共用电子对的偏移程度:O-H>N-H,故答案为:>;
(8)离子晶体的熔沸点与其晶格能成正比,晶格能与离子半径成反比、与电荷成正比,钠离子半径大于镁离子、钠离子电荷小于镁离子,所以熔点:Na2O<MgO,故答案为:<;
(9)同一周期元素,原子半径随着原子序数增大而减小,同一主族元素,原子半径随着原子序数增大而增大,则磷原子半径取值范围为1.02<R<1.17,故答案为:1.02<R<1.17.
点评:本题考查元素周期表和元素周期律的综合应用,侧重考查知识运用能力,涉及晶体熔沸点比较、元素周期律知识,以第三周期、第IA族、第VIIA族为例熟练掌握同一周期、同一主族元素原子结构及性质递变规律,题目难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
下列叙述正确的是( )
| A、核素就是同位素 |
| B、元素的金属性强弱与元素失去电子数的多少成正比 |
| C、含有离子键的化合物一定是离子化合物 |
| D、含有共价键的化合物一定是共价化合物 |
下列实验目的无法实现的是( )
| A、用激光笔光束鉴别氯化铁溶液和氢氧化铁胶体 |
| B、用KSCN溶液鉴别Fe3+和Fe2+ |
| C、用氨水鉴别Al3+和Mg2+ |
| D、用焰色反应鉴别碳酸钠溶液和碳酸钾溶液 |
硝基苯中溶有少量CaCl2,适宜的提纯方法是( )
| A、过滤 | B、蒸馏 |
| C、分液 | D、纸上层析 |
向22.4gFe2O3、Cu的混合物中加入0.5mol/L的硫酸溶液750mL,固体完全溶解,则原混合物中Cu的质量可能为( )
| A、1.12 g |
| B、2.2 g |
| C、3.2g |
| D、6.4g |
兴奋剂是体育比赛中禁用的药物,有一种兴奋剂的结构如图.关于它的说法中正确的是( )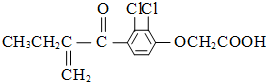

| A、该有机物能发生银镜反应 |
| B、分子中有4个碳碳双键 |
| C、既能发生还原反应,又能发生氧化反应 |
| D、1 mol 该物质最多跟6 mol氢气发生反应 |
俗话说“雷雨发庄稼”这是因为雷雨天空气中的某些物质之间发生了一系列化学反应,最终产生了氮肥.下列不属于其中的反应的是( )
A、N2+O2
| |||
| B、2NO+O2→2NO2 | |||
| C、3NO2+H2O→2HNO3+NO | |||
D、4NH3+5O2
|
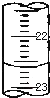 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: