题目内容
27.75 g某+2价金属的氯化物(MCl2)中含有3.01×1023个Cl-,则M的相对原子质量为 .
考点:物质的量的相关计算
专题:计算题
分析:根据MCl2中的Cl-的数目求出其物质的量,然后再求出M2+的物质的量,即MCl2的物质的量,最后根据M=
求出MCl2的摩尔质量;根据摩尔质量在以g/mol为单位时在数值上等于相对分子质量求出MCl2的相对分子质量,最后求出金属M的相对原子质量.
| m |
| n |
解答:
解:因MCl2中含有3.01×1023个Cl-,则Cl-的物质的量为
=0.5mol,即MCl2的物质的量为0.25mol,MCl2的摩尔质量M=
=
=111g/mol,
所以相对分子质量为111,金属M的相对原子质量为111-35.5×2=40,
故答案为:40.
| 3.01×1023 |
| 6.02×1023mol-1 |
| m |
| n |
| 27.75g |
| 0.25mol |
所以相对分子质量为111,金属M的相对原子质量为111-35.5×2=40,
故答案为:40.
点评:本题要求学生知道摩尔质量在数值上和相对分子质量的大小相等以及质量、摩尔质量、物质的量之间的关系公式,难度不大.

练习册系列答案
相关题目
已知16g A物质和12g B物质恰好完全反应,生成6.8g C物质、3.6g D物质和0.2mol E物质,则E物质的摩尔质量为( )
| A、48g/mol |
| B、88g/mol |
| C、112g/mol |
| D、132g/mol |
在实验室中,下列除杂的方法中正确的是( )
| A、溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴 |
| B、乙烷中混有乙烯,通入H2在一定条件下反应,使乙烯转化为乙烷 |
| C、硝基苯中混有浓硫酸和浓硝酸,将其倒入NaOH溶液中,静置,分液 |
| D、乙烯中混有CO2和SO2,将其通入NaOH溶液中洗气 |
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器I(恒容)和Ⅱ(恒压)中,使其发生反应,t.时容器I中达到化学平衡,x、Y、z的物质的量的变化如图所示,则下列有关推断正确的是( )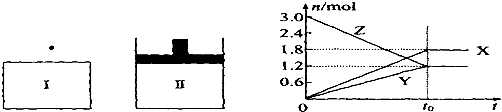

| A、该反应的化学方程式为:3X+2Y?3Z |
| B、若两容器中均达到平衡后,两容器的体积V(I)<V(Ⅱ),则容器Ⅱ达到平衡所用时间小于t |
| C、若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 |
| D、达平衡后,若对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应 |
大气或饮水被某种元素污染时,会引起牙齿、骨骼变疏松.这种元素是( )
| A、汞 | B、氟 | C、碘 | D、氯 |
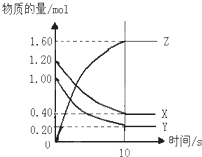 如右图所示,某温度下,物质的量分别是1.2mol的气体X和物质的量为1.0mol的气体Y,在2L密闭容器中反应生成气体Z,反应5min后测得n(X)=0.4mol,n(Y)=0.2mol,生成的n(Z)=1.6mol,则该反应的化学方程式可表示为
如右图所示,某温度下,物质的量分别是1.2mol的气体X和物质的量为1.0mol的气体Y,在2L密闭容器中反应生成气体Z,反应5min后测得n(X)=0.4mol,n(Y)=0.2mol,生成的n(Z)=1.6mol,则该反应的化学方程式可表示为