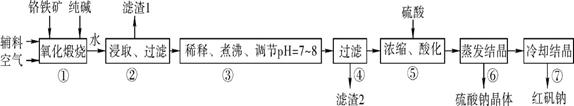
题目内容
15. Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:
Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:| 元素 | 相关信息 |
| Q | Q的单质是实验室常用的惰性电极材料 |
| R | R原子基态时2p原子轨道上有3个未成对电子 |
| T | 负二价的元素T的氢化物在通常情况下是一种液体,且 T的质量分数为88.9% |
| X | X是第三周期电负性最大的元素 |
| Y | 元素Y位于周期表第10列 |
| Z | Z存在质量数为65,中子数为36的核素 |
(2)下列叙述正确的是d
a.Q的最简单气态氢化物比R的气体氢化物稳定
b.Q的含氧酸一定比R的含氧酸酸性强
c.R的气态氢化物的熔点在同族元素形成的氢化物中最低
d.R的第一电离能、电负性都比Q大
(3)Q和T可形成两种常见化合物,分别表示为QT与QT2.QT分子中σ键π键的个数比为1:2;QT2分子中,Q原子采取sp杂化.
(4)笑气(R2T)是一种麻醉剂,有关理论认为R2T与QT2具有相似的结构.故的空间构型为直线形,且为非极性(填“极性”或“非极性”)分子.
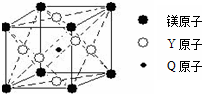
(5)现有Q、Y和镁三种元素的某种晶体具有超导性,其晶胞结构如图所示.该晶体的化学式为MgNi3C;晶体中每个镁原子周围距离相等且最近的Y原子有12个.
分析 Q的单质是实验室常用的惰性电极材料,则Q为碳元素;R原子基态时2p原子轨道上有3个未成对电子,原子核外电子排布式为1s22s22p3,故R为N元素;负二价的元素T和氢的化合物在通常情况下是一种液体,其中T的质量分数为88.9%,负二价的元素T和氢的化合物为H2X,令T的相对分子质量为a,则$\frac{a}{a+2}$=88.9%,解得a=16,所以T为O元素;X是第三周期电负性最大的元素,则X为Cl;元素Y位于周期表第10列,则Y为Ni;Z存在质量数为65,中子数为36的核素,则质子数为65-36=29,故Z为Cu.
解答 解:Q的单质是实验室常用的惰性电极材料,则Q为碳元素;R原子基态时2p原子轨道上有3个未成对电子,原子核外电子排布式为1s22s22p3,故R为N元素;负二价的元素T和氢的化合物在通常情况下是一种液体,其中T的质量分数为88.9%,负二价的元素T和氢的化合物为H2X,令T的相对分子质量为a,则$\frac{a}{a+2}$=88.9%,解得a=16,所以T为O元素;X是第三周期电负性最大的元素,则X为Cl;元素Y位于周期表第10列,则Y为Ni;Z存在质量数为65,中子数为36的核素,则质子数为65-36=29,故Z为Cu.
(1)Z为Cu元素的原子基态时的电子排布式是:1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(2)a.非金属性Q(碳)<R(N),故R的最简单气态氢化物比Q的气体氢化物稳定,故a错误;
b.碳酸为弱酸,而硝酸为强酸,故b错误;
c.氨气分子之间形成氢键,熔点在同族元素形成的氢化物中高于其它分子晶体的,故c错误;
d.同周期自左而右电负性增大,氮元素原子2p能级为半满稳定状态,能量较低,N元素的第一电离能、电负性均比碳的大,故d正确,
故选:d;
(3)Q和T可形成两种常见化合物,分别表示为CO与CO2.CO分子结构简式为C≡O,分子中σ键π键的个数比为1:2,CO2分子为直线型结构,C原子采取sp杂化,
故答案为:1:2;sp;
(4)有关理论认为N2O与CO2具有相似的结构,故的空间构型为直线形,且为非极性分子,
故答案为:直线形;非极性;
(5)含有C、Ni和镁三种元素的某种晶体具有超导性,根据晶胞结构可知,晶胞中Mg原子数目为8×$\frac{1}{8}$=1,C原子数目为1,Ni原子数目为6×$\frac{1}{2}$=3,则该晶体的化学式为MgNi3C;晶体中每个镁原子周围距离最近的Ni原子处于以Mg为顶点的面心上,补全晶胞可知,Mg原子为12个面共用,故晶体中每个镁原子周围距离最近的Ni原子有12个,
故答案为:MgNi3C;12.
点评 本题是对物质结构与性质的考查,涉及核外电子排布规律、电离能、电负性、化学键、分子结构与性质、晶胞结构及计算等,难度中等,推断元素是解题关键,注意利用均摊法进行晶胞的有关计算.

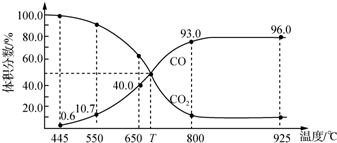
下列说法正确的是( )
| A. | 550℃时,若充入惰性气体,v(正)、v(逆)均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,此反应的平衡常数K=2 304,保持温度不变,若缩小体积,K值将变小 |
| A. | 某条件下可逆反应达到限度之前,逆反应速率逐渐增大可能与生成物浓度逐渐增大有关 | |
| B. | 可逆反应的限度不随反应条件的改变而改变 | |
| C. | 化学反应的限度决定了反应物在该条件下的最大转化率 | |
| D. | 炼铁高炉尾气中CO含量不随高炉高度改变而改变,是因为有关反应达到了限度 |
| A. | 光导纤维应避免在强碱环境中使用 | |
| B. | 船体镀锌或镀锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 利用碳酸酯聚合材料生产一次性饭盒,可以减少对环境产生的白色污染 | |
| D. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 |
| A. | 硫在氧气中燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的气体 | |
| B. | 碳在空气中燃烧,发出白光,生成使澄清石灰水变浑浊的气体 | |
| C. | 红磷在空气中燃烧,产生大量白色烟雾 | |
| D. | 将分别装有氨水和酚酞溶液的两只烧杯靠近,氨水先变红 |
| A. | 一定条件下,将1 mol N2和3 mol H2混合发生反应,转移的电子总数为6 NA | |
| B. | 1 L 0.1 mol•L-1的Na2CO3溶液中阴离子的总数大于0.1 NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有2 mol Fe2+被氧化时,消耗Cl2的分子数为NA | |
| D. | 1 mol-CH3中所含的电子总数为10 NA |