题目内容
CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关.
(1)人们利用CO能与金属镍反应,生成四羰基镍,然后将四羰基镍分解从而实现镍的提纯,最后可以得到纯度达99.9%的高纯镍.具体反应为:Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
该反应的△H 0(选填“>”或“=”或“<”.
(2)工业上可利用CO生产乙醇:
2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H1
有已知:H2O(1)═H2O(g)△H2
CO(g)+H 2 O(g)?CO2(g)+H2(g)△H3
工业上也可利用CO2与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(1)△H
则:△H与△H1、△H2、△H3之间的关系是:△H= .
(3)-定条件下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)
下列选项能判断该反应达到平衡状态的依据的有 .
A.2v(H2)=v (CO)
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(4)工业可采用CO与H2反应合成再生能源甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g)
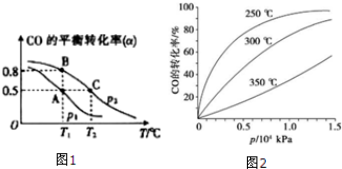
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇.CO的平衡转化率(a)与温度(T)、压强(p)的关系如(图1)所示.
①合成甲醇的反应为 (填“放热”或“吸热”)反应.
②A、B、C三点的平衡常数Ka、Kb、Kc的大小关系 为 .
③若达到平衡状态A时,容器的体积为10L,则在平衡 状态B时容器的体积为 L.
④CO的平衡转化率(α)与温度(T)、压强(p)的关系如 (图2)所示,实际生产时条件控制在250°C、1.3×104kPa左右,选择此压强的理由是 .
(1)人们利用CO能与金属镍反应,生成四羰基镍,然后将四羰基镍分解从而实现镍的提纯,最后可以得到纯度达99.9%的高纯镍.具体反应为:Ni(s)+4CO(g)
 Ni(CO)4(g)
Ni(CO)4(g)该反应的△H
(2)工业上可利用CO生产乙醇:
2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H1
有已知:H2O(1)═H2O(g)△H2
CO(g)+H 2 O(g)?CO2(g)+H2(g)△H3
工业上也可利用CO2与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(1)△H
则:△H与△H1、△H2、△H3之间的关系是:△H=
(3)-定条件下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)
下列选项能判断该反应达到平衡状态的依据的有
A.2v(H2)=v (CO)
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(4)工业可采用CO与H2反应合成再生能源甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇.CO的平衡转化率(a)与温度(T)、压强(p)的关系如(图1)所示.
①合成甲醇的反应为
②A、B、C三点的平衡常数Ka、Kb、Kc的大小关系 为
③若达到平衡状态A时,容器的体积为10L,则在平衡 状态B时容器的体积为
④CO的平衡转化率(α)与温度(T)、压强(p)的关系如 (图2)所示,实际生产时条件控制在250°C、1.3×104kPa左右,选择此压强的理由是

考点:化学平衡的计算,热化学方程式,化学平衡的影响因素,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)由反应条件可知,低温有利于向正反应进行,高温有利于向逆反应进行,降低温度平衡向放热反应移动,据此判断;
(2)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减;
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)①由图1可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动;
②平衡常数与压强无关,只与温度有关,结合平衡移动判断;
③A、B两点温度相等,压强不同,平衡常数相同,利用三段式计算A、B两点平衡时各组分物质的量,根据A点各物质的浓度计算平衡常数,再根据平衡常数计算B点体积;
④由图3可知,在250°C、1.3x104kPa左右,时CO的转化率已较高,再增大压强CO转化率提高不大,且增大成本.
(2)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减;
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)①由图1可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动;
②平衡常数与压强无关,只与温度有关,结合平衡移动判断;
③A、B两点温度相等,压强不同,平衡常数相同,利用三段式计算A、B两点平衡时各组分物质的量,根据A点各物质的浓度计算平衡常数,再根据平衡常数计算B点体积;
④由图3可知,在250°C、1.3x104kPa左右,时CO的转化率已较高,再增大压强CO转化率提高不大,且增大成本.
解答:
解:(1)由反应条件可知,低温有利于向正反应进行,高温有利于向逆反应进行,降低温度平衡向放热反应移动,故该反应正反应为放热反应,即△H<0,故答案为:<;
(2)已知:①2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H1
②H2O(1)═H2O(g)△H2
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
根据盖斯定律,则①-②×3-③×2得2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O,则:△H=△H1-3△H2-2△H3,
故答案为:H=△H1-3△H2-2△H3;
(3)A.2v(H2)=v (CO)中未指明正逆速率,不能说明得到平衡,故A错误;
B.CO的消耗速率等于CH3OCH3的生成速率,均表示正反应速率,不能说明到达平衡,故B错误;
C.容器体积不变,随反应进行气体物质的量减小,压强减小,容器内的压强保持不变,说明到达平衡,故C正确;
D.容器体积不变,混合气体总质量不变,混合气体密度始终保持不变,不能说明得到平衡,故D错误;
E.混合气体总质量不变,随反应进行气体物质的量减小,混合气体平均相对分子质量减小,当混合气体的平均相对分子质量不随时间而变化,说明反应到达平衡,故E正确,
故答案为:CE;
(4)①由图1可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,即正反应为放热反应,故答案为:放热;
②平衡常数与压强无关,只与温度有关,A、B温度相等,则Ka=Kb,相同压强下,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,则平衡常数减小,故Kb>Kc,故Ka=Kb>Kc,
故答案为:Ka=Kb>Kc;
③A、B两点温度相等,压强不同,平衡常数相同,
对应A点,CO转化率为0.5,参加反应CO为10mol×0.5=5mol,
CO(g)+2H2(g)?CH3OH(g)
开始(mol):10 20 0
转化(mol):5 10 5
平衡(mol):5 10 5
故T1温度下,平衡常数K=
=1
对应B点,CO转化率为0.8,参加反应CO为10mol×0.8=8mol,
CO(g)+2H2(g)?CH3OH(g)
开始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设平衡时的体积为VL,则
=1,解得V=2
故答案为:2;
④由图3可知,在250°C、1.3x104kPa左右,CO的转化率已较高,再增大压强CO转化率提高不大,且增大生成成本,得不偿失,故选择250°C、1.3x104kPa左右,
故答案为:在250°C、1.3x104kPa左右,CO的转化率已较高,再增大压强CO转化率提高不大,且增大生成成本,得不偿失.
(2)已知:①2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H1
②H2O(1)═H2O(g)△H2
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
根据盖斯定律,则①-②×3-③×2得2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O,则:△H=△H1-3△H2-2△H3,
故答案为:H=△H1-3△H2-2△H3;
(3)A.2v(H2)=v (CO)中未指明正逆速率,不能说明得到平衡,故A错误;
B.CO的消耗速率等于CH3OCH3的生成速率,均表示正反应速率,不能说明到达平衡,故B错误;
C.容器体积不变,随反应进行气体物质的量减小,压强减小,容器内的压强保持不变,说明到达平衡,故C正确;
D.容器体积不变,混合气体总质量不变,混合气体密度始终保持不变,不能说明得到平衡,故D错误;
E.混合气体总质量不变,随反应进行气体物质的量减小,混合气体平均相对分子质量减小,当混合气体的平均相对分子质量不随时间而变化,说明反应到达平衡,故E正确,
故答案为:CE;
(4)①由图1可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,即正反应为放热反应,故答案为:放热;
②平衡常数与压强无关,只与温度有关,A、B温度相等,则Ka=Kb,相同压强下,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,则平衡常数减小,故Kb>Kc,故Ka=Kb>Kc,
故答案为:Ka=Kb>Kc;
③A、B两点温度相等,压强不同,平衡常数相同,
对应A点,CO转化率为0.5,参加反应CO为10mol×0.5=5mol,
CO(g)+2H2(g)?CH3OH(g)
开始(mol):10 20 0
转化(mol):5 10 5
平衡(mol):5 10 5
故T1温度下,平衡常数K=
| ||||
|
对应B点,CO转化率为0.8,参加反应CO为10mol×0.8=8mol,
CO(g)+2H2(g)?CH3OH(g)
开始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设平衡时的体积为VL,则
| ||||
|
故答案为:2;
④由图3可知,在250°C、1.3x104kPa左右,CO的转化率已较高,再增大压强CO转化率提高不大,且增大生成成本,得不偿失,故选择250°C、1.3x104kPa左右,
故答案为:在250°C、1.3x104kPa左右,CO的转化率已较高,再增大压强CO转化率提高不大,且增大生成成本,得不偿失.
点评:本题考查化学平衡常数有关计算、化学平衡图象及影响因素、化学平衡状态判断、反应热计算,注意掌握化学平衡常数的应用,掌握三段式计算方法,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
具有下列电子排布式的原子中,半径最大的是( )
| A、1s22s22p63s23p1 |
| B、1s22s22p1 |
| C、1s22s22p3 |
下列各组粒子中,互为同位素的是( )
| A、H D |
| B、O2 O3 |
| C、红磷 白磷 |
| D、H2 D2 |
下列关于中和滴定的操作错误的是( )
| A、滴定前需要检查滴定管是否漏水 |
| B、用对应加入的溶液润洗的仪器有:酸式滴定管、锥形瓶 |
| C、用标准盐酸测定氨水的浓度,最适宜使用的指示剂是甲基橙 |
| D、已知浓度滴定未知碱液,终点读数时俯视滴定管的刻度,会造成计算值偏低 |