题目内容
18.在一定条件下,对于密闭容器中进行的可逆反应:2HI(g)?H2 (g)+I2 (g),下列说法中可以充分说明这一反应已经达到化学平衡状态的是( )| A. | HI、H2、I2的浓度相等 | B. | HI、H2、I2的浓度不再发生变化 | ||
| C. | HI、H2、I2在密闭容器中共存 | D. | 反应停止,正、逆反应速率都等于零 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、化学平衡时,HI、H2、I2的浓度不变,但不一定相等,故A错误;
B、HI、H2、I2的浓度不再发生变化,说明达平衡状态,故B正确;
C、可逆反应始终是HI、H2、I2在密闭容器中共存的体系,故C错误;
D、化学平衡是动态平衡,当反应达到平衡状态时,正逆反应速率相等,但不为0,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
6.下列分子或离子中空间构型是V形的是( )
| A. | H3O+ | B. | H2O | C. | NO2+ | D. | NO2- |
13.下列说法正确的是( )
| A. | 相对分子质量相近的醇比烷烃沸点高是因为醇分子间存在氢键 | |
| B. | 分子式为C10H14苯环上只有一个取代基的芳香烃,其可能的结构有3种 | |
| C. | 红外光谱分析不能区分乙醇和乙酸乙酯 | |
| D. | 蛋白质溶液中加硫酸铵或氯化铜溶液,均会发生蛋白质的变性 |
10.一定条件下,某反应在恒容密闭容器中发生,容器内各物质的浓度随时间的变化如图所示(所有物质均为气体),下列说法正确的是( )


| A. | 该反应的方程式A+B?C | |
| B. | t1时刻反应达到平衡状态 | |
| C. | t2时刻,正反应速率大于逆反应速率 | |
| D. | 0~30min,用B表示该反应速率为0.03mol•L-1•min-1 |
6.关于中和热测定实验的下列说法不正确的是( )
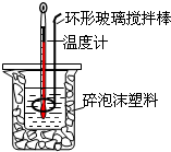

| A. | 使用环形玻璃棒既可以搅拌又避免损坏温度计 | |
| B. | 测了酸后的温度计要用水清洗后再测碱的温度 | |
| C. | 向盛装酸的烧杯中加碱时要小心缓慢以免洒出 | |
| D. | 改变酸碱的用量,所求中和热数值不变 |
7.利用Y型管与其它仪器组合可以进行许多实验(固定装置略).分析并回答下列问题:
| 实验 | 装置 |
| (1)实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为管壁内有淡黄色固体生成;硫化亚铁处加水的目的是稀释浓硫酸,防止硫化氢被氧化. |  |
| (2)实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是抬高(或移动)水准管位置,使水准管、量气管内液面相平. ②若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则合金中铁的含量为 69.14%(保留2位小数,气体体积已折算为标况). |  |
| (3)实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y型管中应放置的药品是浓氨水、碱石灰(必要时可以加热),该沉淀的化学式为BaSO3. |  |
 在常温下,Fe 与水并不发生反应,但在高温下,Fe 与水蒸气可以发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,即可以完成高温下Fe 与水蒸气的反应实验.
在常温下,Fe 与水并不发生反应,但在高温下,Fe 与水蒸气可以发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,即可以完成高温下Fe 与水蒸气的反应实验.
