题目内容
4.Na2FeO4是一种新型的净水消毒剂,工业上常以NaClO、FeCl3和NaOH为原料,生产Na2FeO4.下列有关说法正确的是( )| A. | 生成2molNa2FeO4时,还原得到的Cl-为9mol | |
| B. | 当有6mole-转移时,反应生成的Na2FeO4为332g | |
| C. | 该制备反应的氧化剂是FeCl3 | |
| D. | 每生成1molNa2FeO4时,消耗10molNaOH |
分析 发生2FeCl3+3NaClO+10NaOH═2Na2FeO4+9NaCl+5H2O,Fe元素的化合价升高,Cl元素的化合价降低,以此来解答.
解答 解:A.生成2molNa2FeO4时,NaClO中Cl元素得到电子被还原,则还原得到的Cl-为3mol,故A错误;
B.该反应中6mole-转移时,反应生成的Na2FeO4为2mol,其质量为2mol×166g/mol=332g,故B正确;
C.Cl元素的化合价降低,NaClO为氧化剂,故C错误;
D.由反应可知,每生成2molNa2FeO4时,消耗10molNaOH,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、基本概念为解答的关键,侧重分析与应用能力的考查,注意氯化铁中Cl元素的化合价不变,题目难度不大.

练习册系列答案
相关题目
15.下列说法不正确的是( )
| A. | 铁粉表面的油污用热的纯碱溶液去油污效果更好 | |
| B. | 常温下,向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 制备无水的AlCl3、FeCl3均不能采用将溶液在空气中直接蒸干的方法 | |
| D. | 室温下,向0.1mol•L-1的HF溶液中加入水溶液显碱性的物质,HF的电离程度一定增大 |
9.下列各组物质的水溶液,不用其他试剂无法鉴别出来的是( )
| A. | Na2CO3、NaHSO4 | B. | CuSO4、BaCl2 | C. | AgNO3、NH3•H2O | D. | MgCl2、NaOH |
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移4NA个电子 | |
| B. | 100g质量分数为98%的浓硫酸中所含有的氧原子数为4NA | |
| C. | NA个H2分子与NA个D2O分子的质量比为1:9 | |
| D. | 标准状况下,5.6g乙烯和丙烯的混合气体中含C-H键的数目为0.8NA |
1.分子式为C4H10O,属于醇的同分异构体有多少种( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
2.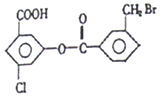 某有机物的结构简式如图:1mol该有机物与足量的氢氧化钠溶液混合并共热,
某有机物的结构简式如图:1mol该有机物与足量的氢氧化钠溶液混合并共热,
充分反应后最多可消耗氢氧化钠的物质的量为( )
 某有机物的结构简式如图:1mol该有机物与足量的氢氧化钠溶液混合并共热,
某有机物的结构简式如图:1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为( )
| A. | 4mol | B. | 5mol | C. | 6mol | D. | 7mol |