题目内容
16.将足量的铝粉分别投入等物质的量浓度的NaOH溶液和盐酸中,待反应结束后恢复至常温,两者产生的气体在相同状况下占有相同的体积.下列叙述错误的是( )| A. | NaOH溶液和盐酸的体积相等 | B. | 消耗铝的质量相等 | ||
| C. | 两反应中转移的电子数相等 | D. | 反应后两溶液的pH均小于7 |
分析 足量铝粉分别投入等物质的量浓度的NaOH溶液和盐酸中,发生反应:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,生成的氢气相等,假设生成的氢气的物质的量为3mol,根据方程式计算生成氯化铝、偏铝酸钠的物质的量,混合后铝离子再与偏铝酸根发生水解反应,以此解答该题.
解答 解:足量铝粉分别投入等物质的量浓度的NaOH溶液和盐酸中,发生反应:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
A.参加反应的铝相等,分别生成NaAlO2、AlCl3,根据铝元素守恒NaAlO2、AlCl3物质的量相等,根据钠离子是故n(NaOH)=n(NaAlO2),根据氯离子守恒n(HCl)=3n(AlCl3),盐酸与氢氧化钠的浓度相同,故消耗的氢氧化钠与盐酸的体积之比等于1:3,故A错误;
B.属提供的电子相等,故消耗的铝的物质的量相等,故B正确;
C.反应中铝作还原剂,氢气是还原产物,生成的氢气的体积相等,金属提供的电子相等,故C正确;
D.反应后氢氧化钠溶液生成偏铝酸钠,溶液仍呈碱性,故D错误.
故选AD.
点评 本题考查铝单质及化合物的性质、化学计算等,为高频考点,侧重于学生的分析能力和实验能力的考查,难度中等,注意把握反应的方程式.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
6.下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A. | 0.1 mol•L-1 Na2CO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| B. | pH=12的Ba(OH)2溶液和pH=12的NaHCO3溶液中,水电离的c(H+)相等 | |
| C. | 将0.2 mol•L-1 NaA溶液和0.1 mol•L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| D. | 常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后c(OH-)<c(H+) |
4.同温同压下,等体积的两容器中分别充满NO和CO两种气体(其中N、C、O三种元素分别为14N、13C、18O),则下列说法正确的是( )
| A. | 两容器中分子间的平均距离不相同 | |
| B. | 两容器中所含微粒的质量均相同 | |
| C. | 两容器中所含原子数、分子数、中子数均相同 | |
| D. | 两容器中所含质子数、中子数均相同 |
11.现有甲、乙、丙、丁、戊五种离子化合物形成的溶液,分别由K+、NH4+、Ag+、Ba2+、Fe3+、Cl-、OH-、CO32-、SO42-、NO3-中的阳离子和阴离子各一种组成(五种离子化合物所含阴、阳离子各不相同).已知:①室温时,0.1mol•L-1乙溶液的pH=10,②丙、丁、戊三种溶液的pH均小于7,③丙溶液分别与其他四种溶液反应均生成沉淀,④甲溶液与丁溶液在加热条件下反应既产生白色沉淀又产生刺激性气味的气体,生成的白色沉淀不溶于稀硝酸.根据以上实验事实可以推断( )
| A. | 甲为K2SO4溶液 | B. | 乙为K2CO3溶液 | C. | 戊为Fe(NO3)3溶液 | D. | 丁为(NH4)2SO4溶液 |
1.下列离子反应方程式正确的是( )
| A. | Al(OH)3溶于稀H2SO4中:OH-+H+═H2O | |
| B. | 氨水滴入Al(Cl)3溶液中:Al3++3OH-═Al(OH)3 | |
| C. | MgO溶于稀HCl中:O2-+2H+═H2O | |
| D. | 铝溶解在NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ |

 ;
;
 ),完成以邻甲基苯酚(
),完成以邻甲基苯酚( )和乙醇为原料制备合成
)和乙醇为原料制备合成 的路线流程图.
的路线流程图. .
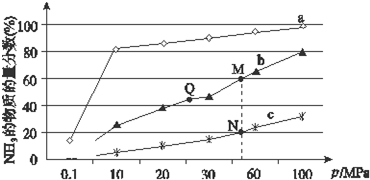
.
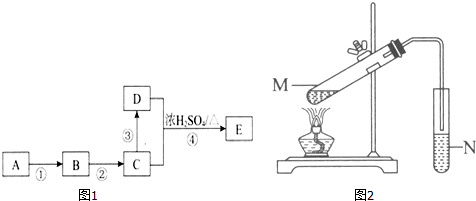
 CH3COOC2H5+H2O;下列说明该反应已经达到化学平衡状态的是ad.
CH3COOC2H5+H2O;下列说明该反应已经达到化学平衡状态的是ad.