题目内容
将PH=5的H2SO4溶液稀释500倍,稀释后,C(H+)与C(SO42-)的比值近似为( )
| A、1﹕1 | B、1﹕2 |
| C、10﹕1 | D、2﹕1 |
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:由溶液pH=5,计算原溶液中c(H+),原溶液中c(SO42-)=
c(H+),稀释500倍,此时溶液接近中性,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而稀释过程中硫酸根的物质的量不变,计算稀释后溶液中硫酸根的物质的量浓度,据此计算解答.
| 1 |
| 2 |
解答:
解:pH为5的溶液中氢离子浓度为:c(H+)=1×10-5mol/L,硫酸根离子的浓度为:c(SO42-)=
c(H+)=
×1×10-5mol/L=5×10-6mol/L;
溶液稀释500倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而硫酸根离子浓度为:c(SO42-)=5×10-6mol/L×
=1×10-8mol/L,
所以稀释后溶液中c(H+)与c(SO42-)的比值近似为:1×10-7mol/L:1×10-8mol/L=10:1,
故选C.
| 1 |
| 2 |
| 1 |
| 2 |
溶液稀释500倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而硫酸根离子浓度为:c(SO42-)=5×10-6mol/L×
| 1 |
| 500 |
所以稀释后溶液中c(H+)与c(SO42-)的比值近似为:1×10-7mol/L:1×10-8mol/L=10:1,
故选C.
点评:本题考查了溶液pH的计算,难度中等,确定溶液中氢离子的近似浓度是关键,注意酸碱稀释接近中性应考虑水的电离.

练习册系列答案
相关题目
在一定条件下,2体积气体X完全分解生成1体积A2和3体积气体B2,(体积在相同条件下测定),则X的化学式是( )
| A、AB |
| B、AB2 |
| C、AB3 |
| D、A2B3 |
下列说法正确的是( )
| A、电解质在溶液中存在电离平衡状态 |
| B、电离平衡状态时v结合=v电离=0 |
| C、弱电解质溶液中,既存在离子也存在分子 |
| D、电解质的电离是可逆过程 |
下列有关离子方程式与所述事实相符合且正确的是( )
| A、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | ||||
| B、Ba(OH)2溶液中逐滴滴加NaHSO4至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | ||||
C、用饱和氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O
| ||||
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2 Fe(OH)3=2 FeO42-+3Cl-+5H2O+4H+ |
判断溶液的酸碱性有多种方法.下列溶液中,一定呈碱性的是( )
| A、能够使甲基橙呈现黄色 |
| B、溶液的pH>7 |
| C、溶液中:c(H+)<c(OH-) |
| D、溶液中:c(H+)>1×10-7mol?L-1 |
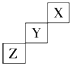 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法中正确的是( )
短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法中正确的是( )| A、Z可能是活泼金属元素 |
| B、X的最高价氧化物对应的水化物是一种强酸 |
| C、Y元素原子的最外层电子数为7 |
| D、Z的最高价氧化物对应水化物的化学式为HZO3 |
NA代表阿伏加德罗常数.下列有关叙述正确的是( )
| A、标准状况下,2.24L H2O含有的分子数等于0.1NA |
| B、常温下,100 mL 1mol/L Na2CO3溶液中钠离子总数为0.1NA |
| C、分子数为NA的CO、N2混合气体体积约为22.4L,质量为28g |
| D、24g O2分子和24g O3分子所含的氧原子数目相等 |