题目内容
17.红砖是用粘土高温烧结而成,因其颜色呈红色或棕红色而得名,常用作建筑材料.(1)根据红砖的颜色、猜测其可能含有的成份是(写化学式)Fe2O3
(2)为了检验猜测是否正确,下面是A同学设计一个实验方案,请你写出各步操作过程以及最后的实验分析和结论,涉及化学反应的写出化学方程式(实验用品任取,不必写实验装置中的仪器安装)
实验步骤:①用铁锤敲碎红砖,取小块磨成粉末.
②将红砖粉末放入烧杯,加入适量HCl,搅拌,发生反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O
③将混合液倒入过滤器过滤
④在滤液中滴入KSCN 溶液
实验分析及结论:若溶液呈血红色,证明红砖含有Fe2O3;若溶液不呈血红色,说明红砖不含Fe2O3
(3)往浅绿色溶液中加入NaOH溶液,得到白色的沉淀迅速变灰绿再变红褐,请写出白色沉淀变红褐色沉淀的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 氧化铁是红棕色物质,可猜想红砖的成分为氧化铁;要证明氧化铁,即要检验铁离子,需要把氧化铁转变为可溶性铁的化合物,用KSCN溶液检验,
(1)氧化铁为红色氧化物;
(2)①用铁锤敲碎红砖,取小块磨成粉末;
②将红砖粉末放入烧杯,加入适量稀盐酸,搅拌,氧化铁溶解生成氯化铁和水;
③将混合液倒入过滤器过滤,
④利用铁离子结合SCN-离子形成血红色溶液检验铁离子的存在;
(3)往浅绿色溶液中加入NaOH溶液,得到白色的沉淀迅速变灰绿再变红褐,氢氧化亚铁被空气中氧气氧化生成氢氧化铁;
解答 解:(1)氧化铁为红棕色固体,故根据红砖的颜色猜测其可能成分为Fe2O3,
故答案为:Fe2O3
(2)氧化铁和盐酸反应生成氯化铁,过滤除去不溶性杂质得氯化铁溶液,与KSCN溶液反应呈红色,故实验步骤为:
①用铁锤敲碎红砖,取小块磨成粉末;
②将红砖粉末放入烧杯,加入适量稀盐酸,搅拌,氧化铁溶解生成氯化铁和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,
故答案为:HCl,Fe2O3+6H+=2Fe3++3H2O;
③将混合液倒入过滤器过滤,
④利用铁离子结合SCN-离子形成血红色溶液的现象得到实验分析及结论:在滤液中滴入KSCN溶液,若溶液呈红色,证明红砖含有Fe2O3;若溶液不呈红色,说明红砖不含Fe2O3,
故答案为:KSCN 溶液;若溶液呈血红色,证明红砖含有Fe2O3;若溶液不呈血红色,说明红砖不含Fe2O3;
(3)往浅绿色溶液中加入NaOH溶液,出现白色沉淀迅速变为灰绿色,最终变为红褐色,白色沉淀转化为红褐色沉淀的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
点评 本题考查了铁的氧化物性质实验分析判断、反应现象的理解应用、中方程式书写,掌握基础是解题关键,题目难度不大.

| A. | 氢化物的稳定性甲>乙>丙 | |
| B. | 甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:丙<甲 | |
| C. | 原子半径由大到小的顺序为:甲>乙 | |
| D. | 乙元素的族序数比甲元素的族序数大 |
| A. | 甲烷的比例模型: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 氯化氢的电子式: | D. | S2-的结构示意图: |
| A. | 单位时间里消耗n molA2,同时生成2n molAB | |
| B. | 容器中的总压强不随时间而变化 | |
| C. | A2、B2、AB的物质的量之比满足1:2:3 | |
| D. | 单位时间里生成2n molAB的同时生成n molB2 |
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 植物油中加入含有酚酞的NaOH溶液,微热 | 红色变浅,且不再分层 | 油脂发生了水解反应 |
| B | 柠檬醛( )中加入酸性高锰酸钾溶液 )中加入酸性高锰酸钾溶液 | 溶液褪色 | 柠檬醛分子中含有醛基 |
| C | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷发生了水解 |
| D | 向含H2SO4的淀粉水解液中加入新制的Cu(OH)2悬浊液,煮沸 | 没有砖红色沉淀 | 淀粉未水解 |
| A. | A | B. | B | C. | C | D. | D |

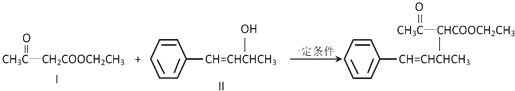
 .
.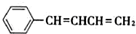 .
. .
. .
.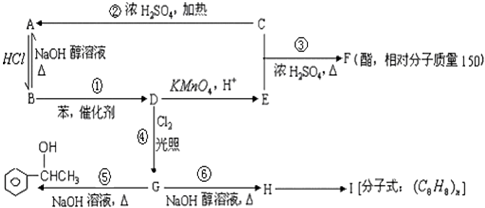

 ;③
;③ +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O;⑥
+H2O;⑥ .
.