题目内容
3.向100g8%的NaOH溶液中通入CO2,生成盐的质量为13.7g(1)通过计算确定产物成分
(2)通过计算确定通入CO2的质量是多少?
分析 n(NaOH)=$\frac{100g×8%}{40g/mol}$=0.2mol,如果生成NaHCO3,其质量=0.2mol×84g/mol=16.8g>13.7g,如果生成的盐是Na2CO3,其质量=$\frac{0.2mol}{2}$×106g/mol=10.6g<13.7g,所以生成的盐是NaHCO3和Na2CO3的混合物,根据钠离子守恒、盐质量列方程计算NaHCO3和Na2CO3的物质的量,再根据碳原子守恒计算二氧化碳的质量.
解答 解:(1)n(NaOH)=$\frac{100g×8%}{40g/mol}$=0.2mol,如果生成NaHCO3,其质量=0.2mol×84g/mol=16.8g>13.7g,如果生成的盐是Na2CO3,其质量=$\frac{0.2mol}{2}$×106g/mol=10.6g<13.7g,所以生成的盐是NaHCO3和Na2CO3的混合物,
答:生成的盐是NaHCO3和Na2CO3的混合物;
(2)设碳酸钠、碳酸氢钠的物质的量分别是xmol、ymol,
根据C原子守恒、盐质量,可得方程组:$\left\{\begin{array}{l}{2x+y=0.2}\\{106x+84y=13.7}\end{array}\right.$
解得x=0.05,y=0.1,
根据C原子守恒n(CO2)=n(NaHCO3)+n(Na2CO3)=0.05mol+0.1mol=0.15mol,
则m(CO2)=0.15mol×44g/mol=6.6g,
答:通过二氧化碳质量为6.6g.
点评 本题考查化学方程式计算、混合物计算,关键是利用极端法确定生成物的组成,侧重考查学生分析计算能力.

练习册系列答案
相关题目
14.现有等体积,等物质的量浓度的NaCl、MgCl2、AlCl3三种溶液,用物质的量浓度相同的AgNO3溶液分别完全沉淀三种溶液中的Cl-.所消耗AgNO3溶液的体积比为( )
| A. | 6:3:2 | B. | 3:2:1 | C. | 1:2:3 | D. | 1:1:1 |
18.对比和类推都是研究物质的性质常用的方法.已知镁和铝都是比较活泼的金属,下列描述正确的是( )
| A. | 高温下,镁和铝在空气中都有抗腐蚀性 | |
| B. | 镁和铝都能跟稀盐酸、稀硫酸和强碱反应 | |
| C. | 镁在点燃条件下可以跟二氧化碳反应,铝在一定条件下可以跟氧化铁发生氧化还原反应 | |
| D. | 铝遇冷的浓硝酸“钝化”,镁遇冷的浓硝酸也发生“钝化” |
15.下列离子方程式中正确的是( )
| A. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | |
| B. | 硫氢化钠水解:HS-+H2O?H3O++S2- | |
| C. | 制Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 硫酸铝溶液跟偏铝酸钠溶液反应:Al3++3AlO2-+6H2O═4Al(OH)3↓ |
8.下列溶液中,溶质的物质的量浓度为1mol•L-1的是( )
| A. | 将40g NaOH溶于1L 水所得的溶液 | |
| B. | 将0.5mol•L-1的NaNO3溶液100mL 加热蒸发掉50g水所得的溶液 | |
| C. | 将23g Na 溶于水并配成1L的溶液 | |
| D. | 含K+为2mol的K2SO4溶液 |
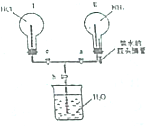 某实验小组在实验室中制取氨气并设计实验验证氨气的某些性质.
某实验小组在实验室中制取氨气并设计实验验证氨气的某些性质.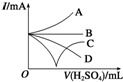 向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题: