题目内容
6.下列过程既是氧化还原反应,又是吸热反应的是( )| A. | Na2O2溶于水 | B. | Ba(OH)2•8H2O与NH4Cl(s)混合并搅拌 | ||
| C. | 灼热的炭与CO2反应 | D. | 铝热反应 |
分析 含元素化合价变化的反应为氧化还原反应,且反应物总能量小于生成物总能量的反应为吸热反应,以此来解答.
解答 解:A.反应生成NaOH和氧气,O元素的化合价变化,为氧化还原反应,但为放热反应,故A不选;
B.Ba(OH)2•8H2O与NH4Cl(s)发生复分解反应,无元素的化合价变化,为非氧化还原反应,且为吸热反应,故B不选;
C.反应生成CO,C元素的化合价变化,为氧化还原反应,且为吸热反应,故C选;
D.铝热反应为放热反应,故D不选;
故选C.
点评 本题考查氧化还原反应及能量变化,为高频考点,把握元素的化合价变化、能量变化为解答的关键,侧重分析与应用能力的考查,注意归纳常见的吸热反应,题目难度不大.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
17.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1 L 0.5 mol•L-1的Fe2(SO4)3 溶液中Fe3+的数目为NA | |
| B. | 室温下,pH=13的NaOH溶液中,OH-离子数目为0.1NA | |
| C. | 0.1 L 0.5 mol•L-1 CH3COOH溶液中含有的氢离子数目小于0.05NA | |
| D. | 电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g |
17.X、Y、Z、W是原子序数依次增大的四种短周期元素.其中只有一种是金属元素,X、W同主族且能形成一种离子化合物WX;Y的气态氢化物与其最高价氧化物的水化物可反应生成一种盐;Z原子的最外层电子数与其电子总数之比为3:4.下列说法中正确的是( )
| A. | 原子半径:W>Z>Y>X | B. | 氢化物稳定性:Y>Z | ||
| C. | WY3中只有离子键没有共价键 | D. | YX3可用于检验Cl2泄漏 |
14.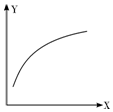 在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
 在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )| X | Y | |
| A | 再加入A | B的转化率 |
| B | 再加入C | A的体积分数 |
| C | 减小压强 | A的转化率 |
| D | 升高温度 | 混合气体平均摩尔质量 |
| A. | A | B. | B | C. | C | D. | D |
1. 甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是 ( )
甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是 ( )
 甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是 ( )
甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是 ( )| A. | 平衡时各容器内c(NO2)的大小顺序为乙>甲>丙 | |
| B. | 平衡时N2O4的百分含量:乙>甲=丙 | |
| C. | 平衡时甲中NO2与丙中N2O4的转化率相同 | |
| D. | 平衡时混合物的平均相对分子质量:甲>乙>丙 |
11.在密闭容器中发生下列反应 aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
| A. | A的转化率变小 | B. | 平衡向正反应方向移动 | ||
| C. | D的物质的量变多 | D. | a>c+d |
15.某课外实验小组设计的下列实验合理的是( )
| A. |  配制一定浓度的H2SO4溶液 | B. |  制取少量NH3 | ||
| C. |  制取并收集NO2 | D. |  制取少量O2 |
16.pH=1的溶液中,能大量共存的一组离子是( )
| A. | Na+、NH4+、Cl-、SO42- | B. | Na+、Ba2+、Cl-、CO32- | ||
| C. | K+、Fe2+、SO32-、NO3- | D. | K+、Fe3+、NO3-、SCN- |