题目内容
8.某学习小组探究铝粉与硝酸钠溶液在不同环境下的反应,进行了如下实验,根据实验过程回答相关问题:(1)实验一
| 装置 | 步骤 | 现象 |
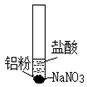 | ⅰ.取少量铝粉于试管,并加入盐酸 | 初始未见明显现象,一段时间后,冒出无色气泡. |
| ⅱ.在试管加入硝酸钠固体 | 继续冒出气泡,液面上方呈浅棕色,试管逐渐变热至沸腾. | |
| ⅲ.用湿润KI-淀粉试纸靠近试管口 | KI-淀粉试纸变蓝色. |
②液面上方呈浅红棕色的原因用化学方程式解释是2NO+O2=2NO2.
③若步骤ⅲ按以下反应式发生,请完成该反应的离子方程式:I-+NO2=NO3-+NO↑+I2
(2)实验二
| 装置 | 步骤 | 现象 |
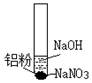 | ⅰ.取少量铝粉于试管,并加入氢氧化钠溶液 | 初始未见明显现象,一段时间后,冒无色气泡. |
| ⅱ.向试管中加入硝酸钠固体 | 继续冒出无色气泡,并有刺激性气味产生 | |
| ⅲ.用湿润红色石蕊试纸靠近试管口 | 试纸变蓝 | |
②步骤ⅱ中产生有刺激性气味气体的电子式是
 .
.③步骤ⅱ反应的离子方程式是8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-.
(3)从实验一、二说明,NO3?在酸性环境中具有氧化性,在碱性环境中具有强氧化性.
分析 (1)①根据铝表面有一层氧化铝保护膜与盐酸反应未见明显现象;
②在试管加入硝酸钠固体,硝酸根与盐酸中的氢离子结合成硝酸,硝酸与铝反应生成NO,NO与氧气反应生成红棕色的NO2;
③用湿润KI-淀粉试纸靠近试管口,KI-淀粉试纸变蓝色,说明NO2将I-氧化产碘单质;
(2)①根据首先是氧化铝保护膜与氢氧化钠反应,后铝与氢氧化钠溶液反应生成氢气;
②向试管中加入硝酸钠固体,继续冒出无色气泡,并有刺激性气味氨气产生;
③根据有刺激性气味氨气产生即铝在碱性条件下雨硝酸根生成氨气,据此书写离子方程式;
(3)从实验一、二说明,NO3?在酸性环境中放出NO,在碱性环境中放出氨气,结合化合价变化分析.
解答 解:(1)①取少量铝粉于试管,并加入盐酸,因为铝表面有一层氧化铝保护膜,盐酸与氧化铝反应生成氯化铝和水未见明显现象,该离子反应为:6H++Al2O3═2Al3++3H2O,故答案为:6H++Al2O3═2Al3++3H2O;
②液面上方呈浅棕色,一定不是氢气,为氮的氧化物NO2,在试管加入硝酸钠固体,硝酸根与盐酸中的氢离子结合成硝酸,硝酸与铝反应生成NO,NO与氧气反应生成红棕色的NO2,化学方程式为2NO+O2=2NO2,故答案为:2NO+O2=2NO2;
③用湿润KI-淀粉试纸靠近试管口,KI-淀粉试纸变蓝色,说明NO2将I-氧化产碘单质,离子方程式为:2I-+2NO2=NO3-+NO↑+I2,故答案为:2I-+2NO2=NO3-+NO↑+I2;
(3)①取少量铝粉于试管,并加入氢氧化钠溶液,首先是氧化铝保护膜与氢氧化钠反应,后铝与氢氧化钠溶液反应生成氢气,故答案为:H2;
②有刺激性气味气体生成,则气体为NH3,电子式为: ,故答案为:
,故答案为: ;
;
②由上述分析可知,碱性条件下Al与NO3-发生氧化还原反应生成氨气,离子反应为8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-,
故答案为:8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-;
(3)从实验一、二说明,NO3?在酸性环境中放出NO,说明NO3?在酸性环境中具有氧化性,在碱性环境中放出氨气,在碱性环境中具有强氧化性,故答案为:氧化性;强氧化性.
点评 本题探究物质的性质,为高频考点,题目难度中等,把握实验方案的设计及发生的氧化还原反应为解答的关键,注意设计思路与物质性质的关系,侧重实验学生分析能力、综合应用能力的考查,较好考查学生实验基本技能.

| A. | 燃烧反应 | B. | 铝热反应 | C. | 碳酸钙分解 | D. | 酸碱中和 |
| A. | Na+、NH4+、Cl-、SO42- | B. | Na+、Ba2+、Cl-、CO32- | ||
| C. | K+、Fe2+、SO32-、NO3- | D. | K+、Fe3+、NO3-、SCN- |
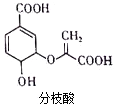
| A. | 分子中含有2种官能团 | |
| B. | 一定条件下,能与乙醇或乙酸发生相同类型的反应 | |
| C. | 1mol分枝酸最多可与3molNaOH发生反应 | |
| D. | 可运用同一原理分别使溴的四氯化碳溶液与酸性高锰酸钾溶液褪色 |
| A. | 铝合金的密度小,硬度大,可用作建筑材料 | |
| B. | 食品工业用Na2CO3作焙制糕点的膨松剂 | |
| C. | FeCl3溶液能与Cu反应,可用于腐蚀铜制印刷电路板 | |
| D. | 明矾能生成Al(OH)3胶体,可用作净水剂 |
| A. |  用图所示装设测定一定时间内生成SO2的反应速率 | |
| B. |  用图所示装置测定稀H2SO4和稀Ca(OH)2的中和热 | |
| C. |  用图所示装置检验火柴燃烧产生的SO2 | |
| D. |  如图装置中X若为苯,可用于吸收NH3或HC1,并防止倒吸 |
| 选项 | 现象或事实 | 解释 |
| A | 泡沫灭火器(含有NaHCO3与硫酸铝)灭火 | 3HCO3-+Al3+=Al(OH)3↓+3CO2↑ |
| B | 将AlCl3溶液加热、蒸干、灼烧,可的导固体Al2O3 | 加热促进了AlCl水解 |
| C | 施肥时,草木灰(有效成分为K2CO3)与NH4Cl混合使用 | 同时使用氮肥和钾肥效果更好 |
| D | 配制SnCl2溶液时,先用盐酸酸化蒸馏水,然后加入SnCl2晶体 | 盐酸抑制SnCl2水解 |
| A. | A | B. | B | C. | C | D. | D |
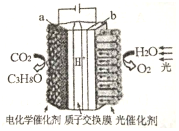 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O 和CO2转化为O2 和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O 和CO2转化为O2 和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从b 极区向a 极区迁移 | |
| C. | 每生成1 mol O2,外电路有2 mol 电子转移 | |
| D. | a 电极的反应为:3CO2+18H+-18e--=C3H8O+5H2 O |