题目内容
11.有关原子最外层电子排布为(n+1)sn(n+1)p n+1的元素及其化合物,下列叙述中不正确的是( )| A. | 氢化物受热易分解 | |
| B. | 该元素是植物生长所需要的一种营养元素 | |
| C. | 其单质既有氧化性又有还原性 | |
| D. | 最高价氧化物对应的水化物是一种强酸 |
分析 由于p能级已经有电子,因此同能层的s能级上电子应为2,即n=2,则该价电子结构实际为3s23p3,是磷元素,以此分析.
解答 解:由于p能级已经有电子,因此同能层的s能级上电子应为2,即n=2,则该价电子结构实际为3s23p3,是磷元素.
A.磷化氢不稳定,受热易分解,故A正确;
B.磷元素是植物生长的营养素,故B正确;
C.P单质的化合价处于中间价态,既有氧化性又有还原性,故C正确;
D.P的最高价氧化物对应的水化物是磷酸,为弱酸,故D错误;
故选D.
点评 本题考查了原子核外电子排布、元素及化合物的性质,具有一定的综合性,难度不大,推断出元素种类是解题的关键.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
2.下列物质属于烃的含氧衍生物的是( )
| A. | CHCl3 | B. | CCl4 | C. |  | D. |  |
19.下列化学反应△H最小的是( )
| A. | NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H1 | |
| B. | NaOH(aq)+$\frac{1}{2}$H2SO4(浓)═$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H4 | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq )+H2O(l);△H2 | |
| D. | CH3COOH(aq)+NaOH(aq)═CH3COONa (aq )+H2O(l);△H3 |
6.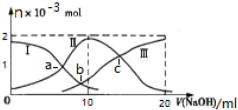 常温下,向10mL某浓度的H2SO3溶液中滴加0.2mol•L-1 NaOH溶液,含S微粒的物质的量变化曲线如图所示,下列有关说法正确的是( )
常温下,向10mL某浓度的H2SO3溶液中滴加0.2mol•L-1 NaOH溶液,含S微粒的物质的量变化曲线如图所示,下列有关说法正确的是( )
 常温下,向10mL某浓度的H2SO3溶液中滴加0.2mol•L-1 NaOH溶液,含S微粒的物质的量变化曲线如图所示,下列有关说法正确的是( )
常温下,向10mL某浓度的H2SO3溶液中滴加0.2mol•L-1 NaOH溶液,含S微粒的物质的量变化曲线如图所示,下列有关说法正确的是( )| A. | 曲线Ⅱ代表H2SO3的浓度 | |
| B. | V(NaOH)=10ml时,溶液温度最高,c(H2SO3)=0.1mol•L-1 | |
| C. | 水的电离程度大小:a点<b点<c点 | |
| D. | 若c点pH=6,则K2(H2SO3)=10-8 |
16.R、T、W、X、Y、Z都是短周期元素,且W、X、Y、Z的核电荷数依次增大.下表列出它们的性质和结构:
(1)Y原子的价电子排布式为3s1,T、X、Z的电负性由大到小的顺序为O>C>Si(用化学符号填空).
(2)WTR分子中的三个原子除W原子外均为8电子构型,根据电子云重叠方式的不同,分子里共价键的类型有σ键和π键.
(3)常温下,RW3是一种刺激性气味、易液化的气体.RW3极易溶于水的原因是NH3与H2O之间易形成氢键.
(4)将过量的RW3气体通入盛有硫酸铜溶液的试管里,现象为先产生蓝色沉淀,后沉淀消失,变成深蓝色的溶液.
| 元素编号 | 元素性质或原子结构 |
| R | 原子价电子排布式为nsnnpn+1 |
| T | 基态原子核外3个能级上有电子,且各能级上的电子数相等 |
| W | 原子电子层数与核外电子数相等 |
| X | 核外s能级上的电子总数与p能级上的电子总数相等 |
| Y | 元素的原子半径在该周期中最大(除稀有气体外) |
| Z | 原子核外p能级上的电子总数比s能级上的电子总数多2 |
(2)WTR分子中的三个原子除W原子外均为8电子构型,根据电子云重叠方式的不同,分子里共价键的类型有σ键和π键.
(3)常温下,RW3是一种刺激性气味、易液化的气体.RW3极易溶于水的原因是NH3与H2O之间易形成氢键.
(4)将过量的RW3气体通入盛有硫酸铜溶液的试管里,现象为先产生蓝色沉淀,后沉淀消失,变成深蓝色的溶液.
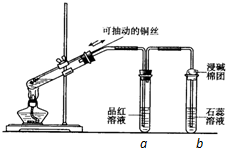 某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.请回答下列问题:
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.请回答下列问题:
 形成六元环酯的结构简式
形成六元环酯的结构简式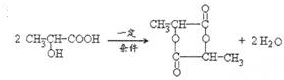 .
.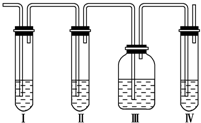 实验室制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量SO2.有人设计下列实验以确认上述混合气体中有乙烯和SO2.
实验室制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量SO2.有人设计下列实验以确认上述混合气体中有乙烯和SO2.