题目内容
2.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )| A. | NaOH固体 | B. | NH4Cl固体 | C. | NaNO3固体 | D. | CH3COONa固体 |
分析 Fe过量,为了减缓反应速率,且不影响生成氢气的总量,可减小氢离子的浓度,但不能改变氢离子的物质的量,以此来解答.
解答 解:A.加NaOH固体,与盐酸反应,生成氢气减少,故A不选;
B.加NH4Cl(s),在溶液中水解生成氢离子,则生成氢气增多,故B不选;
C.加入硝酸钠固体,在酸性条件下硝酸根离子具有强氧化性,与铁反应生成NO,故C不选;
D.加CH3COONa(s),与盐酸反应生成醋酸,氢离子浓度减小,物质的量不变,则减缓反应速率,且不影响生成氢气的总量,故D选.
故选D.
点评 本题考查影响反应速率的因素,为高考常考考点,注意Fe过量,生成氢气由盐酸决定,把握浓度对反应速率的影响即可解答,题目难度不大.

练习册系列答案
相关题目
17.已知氢化亚铜(CuH)是一种难溶、易分解的物质,能与稀盐酸反应,Cu+在酸性条件下发生反应2Cu+═Cu2++Cu,下列有关说法不正确的是( )
| A. | CuH与稀盐酸反应的化学方程式为2CuH+2HCl═CuCl2+2H2↑+Cu | |
| B. | CuH在足量氯气中燃烧的化学方程式为2CuH+Cl2═2Cu+2HCl | |
| C. | CuH在稀硝酸反应的化学方程式为CuH+3HNO3═Cu(NO3)2+NO↑+2H2O | |
| D. | CuH受热分解的化学方程式为2CuH═2Cu+H2↑ |
7.某混合气体通过溴水(使其褪色),再通过灼热的氧化铜(使其黑色变红色),再通过无水硫酸铜白色粉末(使其变蓝色),再通过澄清的石灰水(石灰水由澄清变浑浊,再变澄清),最后剩余气体在空气中点燃,火焰呈蓝色,该混合气体是( )
| A. | 水煤气 | B. | 焦炉煤气 | C. | 石油液化气 | D. | 高炉煤气 |
14.向盛有硫酸锌水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解,得到透明溶液.下列对此现象说法不正确的是( )
| A. | 用硝酸锌溶液代替硫酸锌溶液进行实验,能观察到同样的现象 | |
| B. | 沉淀溶解后,将生成配合离子[Zn(NH3)4]2+ | |
| C. | 反应后溶液中不存在任何沉淀,所以反应前后Zn2+的浓度不变 | |
| D. | 在[Zn(NH3)4]2+离子中,NH3给出孤对电子,Zn2+提供空轨道 |
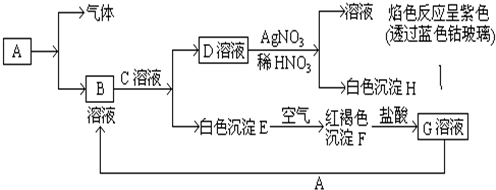
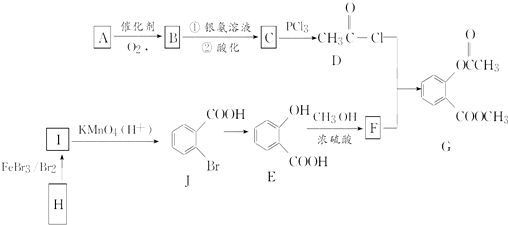
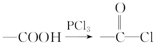
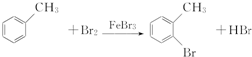 ,E→F的化学方程式为
,E→F的化学方程式为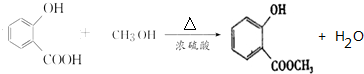 .
.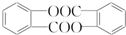 .
.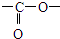 ”结构
”结构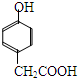 .
.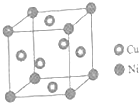 东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题: