题目内容
在热的稀硫酸溶液中溶解了12.16g FeSO4,当加入50mL 0.4mol?L-1 KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3溶液也完全反应,并有NxOy气体逸出,则该NxOy是( )
| A、N2O |
| B、NO |
| C、N2O3 |
| D、NO2 |
考点:氧化还原反应的计算,离子方程式的有关计算
专题:计算题
分析:Fe2+失电子Fe3+,则硫酸亚铁作还原剂,所以硝酸中氮元素得电子化合价降低作氧化剂,利用电子守恒计算.
解答:
解:n(FeSO4)=
=0.08mol,n(KNO3)=0.05L×0.4mol/L=0.02mol,
Fe2+失电子Fe3+,则硫酸亚铁作还原剂,所以硝酸中氮元素得电子化合价降低作氧化剂,
由电子守恒可知,Fe失去电子等于N得到电子,设N被还原后元素化合价为x,则
0.08mol×(3-2)=0.02mol×(5-x),
解得x=+1,
只有N2O中N元素的化合价为+1价,
故选A.
| 12.16g |
| 152g/mol |
Fe2+失电子Fe3+,则硫酸亚铁作还原剂,所以硝酸中氮元素得电子化合价降低作氧化剂,
由电子守恒可知,Fe失去电子等于N得到电子,设N被还原后元素化合价为x,则
0.08mol×(3-2)=0.02mol×(5-x),
解得x=+1,
只有N2O中N元素的化合价为+1价,
故选A.
点评:本题考查氧化还原反应的计算,为高频考点,把握氧化还原反应中得失电子守恒为解本题的关键,注意Fe失去电子,N得到电子,题目难度不大.

练习册系列答案
相关题目
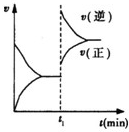 已知A(s)+2B(g)?2C(g)+D(g)△H<0 在一密闭容器中反应的υ-t图.t1时,改变了一个条件,下列叙述正确的是( )
已知A(s)+2B(g)?2C(g)+D(g)△H<0 在一密闭容器中反应的υ-t图.t1时,改变了一个条件,下列叙述正确的是( )| A、t1时,一定是升高了反应的温度 |
| B、t1时,可能是向容器中通入了一定量的C气体 |
| C、t1时,可能是向容器中加入了催化剂 |
| D、t1时改变外界条件后,该反应的平衡常数可能减小,也可能不变 |
地球只有一个,保护环境,就是我们保护自己.我国在环境保护和环境监测上做了大量工作,现又在主要大中型城市实行PM2.5监测,PM2.5监测的是大气中( )
| A、CO2的含量 |
| B、SO2的含量 |
| C、直径小于或等于2.5微米的颗粒物的含量 |
| D、大气中NO2的含量 |
含氮废水中的NH4+在一定条件下可与O2发生以下反应:
①NH4+(aq)+
O2(g)=NO2-(aq)+2H+(aq)+H2O(l)△H=-273kL/mol
②NO2-(aq)+
O2(g)=NO3-(aq)△H=-73kL/mol
下列叙述不正确的是( )
①NH4+(aq)+
| 3 |
| 2 |
②NO2-(aq)+
| 1 |
| 2 |
下列叙述不正确的是( )
| A、升高温度,可使①②反应速率均加快 |
| B、室温下时0.1 mol/L HNO2(aq) pH>1,则NaNO2溶液显碱性 |
| C、NH4+(aq)+2O2(g)═NO3-(aq)+2H+(aq)+H2O(l)△H=-346kJ/mol |
| D、1 mol NH4+在①反应中与1 mol NO2-在②反应中失电子数之比为1:3 |
下列有关化学反应表达错误的是( )
A、实验室用液溴和苯在催化剂作用下制溴苯: | ||
| B、蛋壳溶于食醋:CaCO3+2CH3COOH═(CH3COO)2Ca+H2O+CO2↑ | ||
C、向BrCH2COOH中加入足量的氢氧化钠溶液并加热:BrCH2COOH+OH-
| ||
| D、向苯酚钠溶液中通入少量CO2:CO2+H2O+C6H5O-→C6H5OH+HCO3- |
 下列各组物质中,满足下图物质一步转化关系的选项是( )
下列各组物质中,满足下图物质一步转化关系的选项是( ) )是重要的化工原料,广泛用于香料行业.
)是重要的化工原料,广泛用于香料行业.


 化学电池在通迅、交通及日常生活中有着广泛的应用.
化学电池在通迅、交通及日常生活中有着广泛的应用.