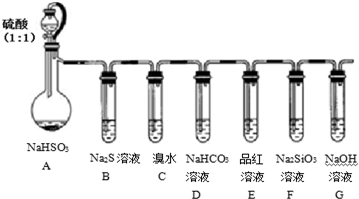
题目内容
8.已知CO2、BF3、SO3都是非极性分子,NH3、H2S、H2O、SO2都是极性分子,由此可推知ABn型分子是非极性分子的经验规律是( )| A. | 分子中所有原子在同一平面 | |
| B. | 在ABn型分子中,A原子最外层电子不一定都成键 | |
| C. | 在ABn分子中,A元素为最高正价 | |
| D. | 分子中不含氢原子 |
分析 根据CO2、BF3、CH4、SO3都是非极性分子,而NH3、H2S、H2O、SO2都是极性分子”知,中心原子上的价电子都形成共价键的分子为非极性分子,存在孤电子对的分子为极性分子.
解答 解:根据CO2、BF3、CH4、SO3都是非极性分子,而NH3、H2S、H2O、SO2都是极性分子”知,中心原子上的价电子都形成共价键的分子为非极性分子,存在孤电子对的分子为极性分子;
A、分子中的所有原子不一定都在同一平面上,如CCl4是正四面体结构,故A错误;
B、在ABn分子中A原子的所有价电子都构成共价键,导致结构对称、正负电荷重心重叠,所以为非极性分子,故B错误;
C、在ABn型分子中,非极性分子中A元素的化合物不一定为最高正价,如CH4中碳为-4价,故C错误;
D、CO2、BF3、SO3都是非极性分子,所以分子可能不含氢,故D正确;
故选D.
点评 本题考查极性分子好和非极性分子,题目难度不大,注意从分子结构是否对称判断分子的极性.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.已知2Fe3++2I-=2Fe2++I2,Br2+2Fe2+=2Br-+2Fe3+.往含有FeBr2、FeI2的混合液中通入一定量的氯气后,再滴加少量的KSCN溶液,溶液变为红色,则下列说法不正确的是( )
| A. | 按I-、Fe2+、Br-的顺序还原性逐渐减弱 | |
| B. | 通入氯气后原溶液中Fe2+一定被氧化 | |
| C. | 原溶液中Br-一定被氧化 | |
| D. | 不能确定通入氯气后的溶液中是否还存在Fe2+ |
14.下列有机反应中,哪一个反应与其它三个反应的反应类型不同的是( )
| A. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | CH3CH2Br+NaOH$\stackrel{H_{2}O}{→}$CH3CH2OH+NaBr | |
| D. | 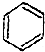 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$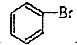 +HBr +HBr |
3.已知碳碳单键可以绕键轴自由旋转,对结构简式为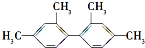 的烃,下列说法正确的是( )
的烃,下列说法正确的是( )
 的烃,下列说法正确的是( )
的烃,下列说法正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至少有11个碳原子处于同一平面上 | |
| C. | 分子中至少有16个碳原子处于同一平面上 | |
| D. | 该烃的苯环上的一氯代物有5种 |
18.下列各离子方程式中,属于水解反应且书写正确的是( )
| A. | CH3COOH+H2O?H3O++CH3COO- | B. | CO32-+2H2O?H2CO3+2OH- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | HS-+H2O?H2S+OH- |