题目内容
9.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ•mol-1、-1411.0kJ•mol-1和-1366.8kJ•mol-1,( C2H4、C2H5OH(l)充分燃烧后的产物为CO2和H2O(l)),则由C2H4(g)和H2O(I)反应生成C2H5OH(1)的△H为( )| A. | -44.2kJ•mol-1 | B. | +44.2kJ•mol-1 | C. | -330kJ•mol-1 | D. | +330kJ•mol-1 |
分析 已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol和-1366.8kJ/mol,则:①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol,③C2H5OH(l)+3O2(g)=3H2O(l)+2CO2 (g)△H=-1366.8kJ/mol,根据盖斯定律 ②-③可得C2H4(g)+H2O(l)=C2H5OH(l),反应热也进行相应的计算.
解答 解:已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol和-1366.8kJ/mol,则三者的热化学方程式分别为:
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol,
③C2H5OH(l)+3O2(g)=3H2O(l)+2CO2 (g)△H=-1366.8kJ/mol,
根据盖斯定律 ②-③可得:C2H4(g)+H2O(l)=C2H5OH(l)△H=(-1411.0kJ/mol)-(-1366.8kJ/mol)=-44.2kJ/mol,
故选A.
点评 本题考查反应热的计算、盖斯定律的应用,题目难度中等,注意掌握盖斯定律的含义及在反应热计算中的应用,明确热化学方程式的书写原则,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
17.在标准状况下,跟11.2L氨气中所含的氢原子数相同的下列物质是( )
| A. | 标准状况8.4LCH4 | B. | 0.3molHCl | C. | 98gH3PO4 | D. | 18gH2O |
4.已知钡的金属活动性处于钾和钠之间,下列反应可以实现的是( )
| A. | 钡可以从氯化钾溶液中置换出钾 | |
| B. | 钡可以从冷水中置换出氢而得到氢气 | |
| C. | 钡可以从氯化钠溶液中置换出钠 | |
| D. | 钡不能置换出金属钠 |
14.短周期主族W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层电子数的3倍,X是迄今发现的非金属性最强的元素,在周期表中Y位于第ⅠA族,Z与W属于同一主族.下列说法正确的是( )
| A. | 简单氢化物的沸点:Z>W | |
| B. | 由W、Y两种元素形成的化合物一定不含共价键 | |
| C. | 简单气态氢化物的热稳定性:X>W | |
| D. | 元素Y和Z的简单离子具有相同的电子层结构 |
1.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2(g)和H2O(g).在298K时:
①N2(g)+2O2(g)═N2O4(g)△H=+7.3kJ•mol-1
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.7kJ•mol-1
下列表示298K时肼跟N2O4反应的热化学方程式,正确的是( )
①N2(g)+2O2(g)═N2O4(g)△H=+7.3kJ•mol-1
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.7kJ•mol-1
下列表示298K时肼跟N2O4反应的热化学方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ•mol-1 | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ•mol-1 | |
| C. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-1 076.7 kJ•mol-1 | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 076.7 kJ•mol-1 |
18.某溶液中含如下离子组中的若干种:K+、Mg2+、Fe3+、Fe2+、Ag+、Cl-、CO32-、NO3-、SO42-、SiO32-、I-,且物质的量浓度相同.某同学欲探究该溶液的组成,进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钻玻璃,观察到紫色火焰
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成
Ⅲ.取Ⅱ反应后的溶液分置于两支试管中,第一支试管中加入BaC12溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层出现紫红色.下列说法正确的是( )
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钻玻璃,观察到紫色火焰
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成
Ⅲ.取Ⅱ反应后的溶液分置于两支试管中,第一支试管中加入BaC12溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层出现紫红色.下列说法正确的是( )
| A. | 原溶液中Fe2+和Fe3+至少有一种,一定没有SiO32-、Ag+ | |
| B. | 步骤Ⅱ中无色气体可能含有CO2,原溶液中可能含有CO32- | |
| C. | 原溶液中肯定含有Cl-、Mg2+ | |
| D. | 为确定是否含有Cl-,可取原溶液加入少量硝酸银和稀硝酸,观察是否产生沉淀 |
3.下列化学用语中,书写不正确的是( )
| A. | 质量数为18的氧核素:${\;}_8^{18}$O | B. | 锂离子的结构示意图: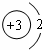 | ||
| C. | 硝基苯的结构简式: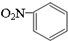 | D. | 四氯化碳的电子式: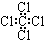 |
 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质,且受热易升华.实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质,且受热易升华.实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃.