题目内容
4.已知钡的金属活动性处于钾和钠之间,下列反应可以实现的是( )| A. | 钡可以从氯化钾溶液中置换出钾 | |
| B. | 钡可以从冷水中置换出氢而得到氢气 | |
| C. | 钡可以从氯化钠溶液中置换出钠 | |
| D. | 钡不能置换出金属钠 |
分析 钡的金属活动性处于钾和钠之间,所以Ba能和冷水反应生成氢气,Ba的金属性大于Zn,据此分析解答.
解答 解:A.Ba的金属活动性介于K和Na之间,则Ba能和KCl溶液中的水反应生成氢氧化钡和氢气,且K的金属活动性大于Ba,所以不能置换出K,故A错误;
B.Ba的金属活动性介于K和Na之间,Na能和冷水反应生成NaOH和氢气,则Ba也能和冷水反应生成氢氧化钡和氢气,故B正确;
C.Ba能和水反应生成氢氧化钡和氢气,虽然Ba的金属活动性大于Na,但Ba不能从氯化钠溶液中置换出Na,故C错误;
D.在溶液中钡不能置换金属钠,但在融化状态下可以置换出金属钠,故D错误;
故选B.
点评 本题考查了金属的性质,根据钠、钾的性质利用知识迁移法分析Ba的性质,题目难度不大.

练习册系列答案
相关题目
14.已知热的氢氧化钾溶液与Cl2可发生如下反应:6KOH+3Cl2═5KCl+KClO3+3H2O则下列说法中正确的是( )
| A. | 该反应中氯气既是氧化剂又是还原剂 | |
| B. | KCl既是氧化产物又是还原产物 | |
| C. | 该反应中的氧化剂只有KOH | |
| D. | 氧化产物与还原产物物质的量之比为5:1 |
12.同温同压下,某容器充满氧气时重116g,若充满CO2时重122g.现充满X气体时重114g,则X气体不可能是( )
| A. | CO | B. | N2 | C. | C2H4 | D. | HCl |
19.用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)该实验中,量取50mL盐酸或NaOH溶液,需要用到的仪器有50mL量筒和胶头滴管;
(2)某同学实验记录的数据如上表所示,其中记录的终止温度是指全反应后混合溶液的最高温度;
(3)计算该实验发生中和反应时放出的热量为1344J[中和后生成的溶液的比热容c=4.2J•(g•℃)-1,稀溶液的密度都为1g•cm-3];
(4)上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度起始温度
(5)若改用60mL0.5mol•L-1盐酸跟50mL0.55mol•L-1氢氧化钠进行反应,实验操作均正确,与上述实验相比,所求的中和热相等(填相等或不相等).
| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(2)某同学实验记录的数据如上表所示,其中记录的终止温度是指全反应后混合溶液的最高温度;
(3)计算该实验发生中和反应时放出的热量为1344J[中和后生成的溶液的比热容c=4.2J•(g•℃)-1,稀溶液的密度都为1g•cm-3];
(4)上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度起始温度
(5)若改用60mL0.5mol•L-1盐酸跟50mL0.55mol•L-1氢氧化钠进行反应,实验操作均正确,与上述实验相比,所求的中和热相等(填相等或不相等).
9.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ•mol-1、-1411.0kJ•mol-1和-1366.8kJ•mol-1,( C2H4、C2H5OH(l)充分燃烧后的产物为CO2和H2O(l)),则由C2H4(g)和H2O(I)反应生成C2H5OH(1)的△H为( )
| A. | -44.2kJ•mol-1 | B. | +44.2kJ•mol-1 | C. | -330kJ•mol-1 | D. | +330kJ•mol-1 |
14.正确认识铁制品的电化学腐蚀与防护方法的是( )
| A. | 铁制品腐蚀时既可作正极也可作负极 | |
| B. | 铁制品腐蚀时铁电极发生反应为:Fe-3e-=Fe2+ | |
| C. | 铁制品腐蚀时或发生析氢腐蚀或发生吸氧腐蚀 | |
| D. | 铁制品连接电源正极可防止腐蚀 |
 从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.
从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.
 +2CH3COOH$\stackrel{浓硫酸}{→}$
+2CH3COOH$\stackrel{浓硫酸}{→}$ +2H2O.
+2H2O.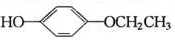 、
、 、
、 、
、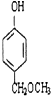 (任写两种)
(任写两种)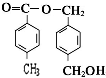 .
.