题目内容
9.能正确表示下列化学反应的离子方程式的是( )| A. | 氢氧化钡溶液与硫酸的反应OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
分析 A.漏掉钡离子与硫酸根离子的反应;
B.澄清的石灰水中氢氧化钙应拆成离子形式;
C.一水合氨为弱碱,应保留化学式;
D.二者反应生成偏铝酸钠和氢气.
解答 解:A.氢氧化钡溶液与硫酸的反应的离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故A错误;
B.澄清的石灰水与稀盐酸反应,离子方程式:OH-+H+═H2O,故B错误;
C.向AlCl3溶液中加入过量的氨水,其离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.铝粉投入到NaOH溶液中,离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑,故D正确;
故选:D.
点评 本题考查离子方程式的书写,为高考高频点,明确离子反应实质是解本题关键,注意化学式的拆分,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.中国已经成为全球最大轿车生产国,汽车尾气正成为城市的主要空气污染源.NO和CO都是汽车尾气中的有害物质,它们能缓慢反应生成N2和CO2,为控制汽车污染有人提出以下建议,你认为合理的是( )
| A. | 增大压强 | B. | 使用催化剂 | ||
| C. | 降低压强 | D. | 升高反应温度加快反应速率 |
20.下表为六种短周期元素的部分性质,下列有关说法错误的是( )
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | 元素R的氧化物对应水化物一定为强酸 | |
| C. | Y2-的半径要小于R- | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |
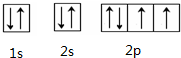
17.下列化学用语正确的是( )
| A. | 聚丙烯的结构简式为: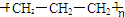 | B. | 丙烷分子的比例模型为: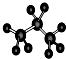 | ||
| C. | 羟基的电子式: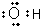 | D. | 2-乙基-1,3-丁二烯分子的键线式: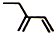 |
14.下列说法正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,相同条件下,前者放出的热量多 | |
| B. | 可逆反应达到平衡,反应就不再进行 | |
| C. | 加入催化剂加快了反应速率,改变了反应吸收或放出的热量 | |
| D. | 同温、同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
1.苯和甲苯都是无色、有芳香气味液体,苯沸点80°,甲苯沸点110°,苯与甲苯混合物分离方法是( )
| A. | 蒸馏 | B. | 重结晶 | C. | 萃取 | D. | 过滤 |
18.砹是原子半径最大的卤族元素,下列预测一定不正确的是( )
| A. | NaAt易溶于苯和四氯化碳等有机溶剂 | |
| B. | At的最高化合价为+7价 | |
| C. | At2是一种有色固体,与H2反应十分缓慢 | |
| D. | AgAt是有色固体,见光易分解 |
19. 得重感冒之后,常吃一种抗生素--头孢氨苄,分子式为C16H17N3O4S•H2O,其化学结构式如图,有关其说法正确的是( )
得重感冒之后,常吃一种抗生素--头孢氨苄,分子式为C16H17N3O4S•H2O,其化学结构式如图,有关其说法正确的是( )
 得重感冒之后,常吃一种抗生素--头孢氨苄,分子式为C16H17N3O4S•H2O,其化学结构式如图,有关其说法正确的是( )
得重感冒之后,常吃一种抗生素--头孢氨苄,分子式为C16H17N3O4S•H2O,其化学结构式如图,有关其说法正确的是( )| A. | 在一定条件下,能发生水解反应生成氨基酸 | |
| B. | 1mol该分子最多能与7molH2反应 | |
| C. | 该分子能与碳酸钠反应,不能与盐酸反应 | |
| D. | 头孢氨苄易溶于水,能使溴水褪色 |
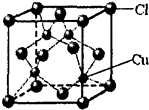 结构决定性质,性质体现结构.对结构和性质的研究是学好化学的基础.
结构决定性质,性质体现结构.对结构和性质的研究是学好化学的基础.