题目内容
4. 结构决定性质,性质体现结构.对结构和性质的研究是学好化学的基础.
结构决定性质,性质体现结构.对结构和性质的研究是学好化学的基础.(1)比较下列各组物质熔沸点高低;
①金刚石(C-C) ②晶体硅(Si-Si) ③金刚砂(Si-C),熔沸点由低到高排列为②③①(填序号)
①金刚石 ②氯化钠 ③硫磺 ④氧化镁,熔沸点由高到低排列为①④②③(填序号)
(2)H2O的沸点高于H2S,主要因为水分子间存在氢键.
(3)[Cu(NH3)4]SO4中所含的化学键有N-H极性键外,还有S-O极性键、离子键.
(4)N、O、S三种元素的第一电离能由大到小顺序为:N>O>S.
(5)NH4CuSO3中的金属阳离子的核外电子排布式为:1s22s22p63s23p63d10 或[Ar]3d10
(6)NH3分子中N原子的杂化方式为:sp3.
(7)与SO2互为等电子体的分子有O3(写一种).
(8)Cr的电子电子排布式:[Ar]3d54s1
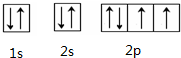
(9)O的轨道表示式:
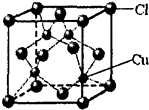
(10)CuCl的晶胞结构如图所示,其中Cl原子的配位数为4.
分析 (1)不同类型晶体中熔沸点:原子晶体>离子晶体>分子晶体,同是原子晶体中,半径越小,键能越大,熔点越高,离子晶体中离子半径越小、离子所带电荷越多,晶格能越大,熔点也越高;
(2)水分子间存在氢键,导致分子间作用力增强,所以沸点较高;
(3)[Cu(NH3)4]SO4中所含的化学键有N-H极性键、S-O极性键、离子键;
(4)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,同一周期从上向下,第一电离能减小;
(5)NH4CuSO3中,Cu原子失去1个电子生成Cu+,其原子核外有28个电子,根据构造原理书写亚铜离子核外电子排布式;
(6)NH3中N形成3个δ键,还有1对孤对电子,N杂化类型为sp3;
(7)等电子体为原子数和价电子数分别相同的分子、离子或原子团;
(8)判断元素原子的核外电子数,先根据构造原理写出电子排布式,再写简易电子排布式;
(9)O原子的核外层8个电子,为1s22s22p4,2p轨道中应为4个单电子;
(10)根据图知,该晶胞中距离每个Cu+最近的Cl-的个数为4.
解答 解:(1)不同类型晶体中熔沸点:原子晶体>离子晶体>分子晶体,同是原子晶体中,半径越小,键能越大,熔点越高,离子晶体中离子半径越小、离子所带电荷越多,晶格能越大,熔点也越高,所以①金刚石(C-C) ②晶体硅(Si-Si) ③金刚砂(Si-C),熔沸点由低到高排列为②③①,①金刚石 ②氯化钠 ③硫磺 ④氧化镁,熔沸点由高到低排列为①④②③,
故答案为:②③①;①④②③;
(2)H2O与H2S都属于分子晶体,H2O分子间可以形成氢键,H2S只含有范德华力,所以水的沸点高于H2S的沸点,
故答案为:水分子间存在氢键;
(3)[Cu(NH3)4]SO4中所含的化学键有N-H极性键、S-O极性键、离子键,
故答案为:S-O极性键、离子键;
(4)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,同一周期从上向下,第一电离能减小,所以S、N、O三种元素的第一电离能由大到小的顺序为:N>O>S,故答案为:N>O>S;
(5)NH4CuSO3中,铜为26号元素,其阳离子为+1价铜离子,所以其核外电子排布式为:1s22s22p63s23p63d10 或[Ar]3d10,
故答案为:1s22s22p63s23p63d10 或[Ar]3d10;
(6)NH3中N形成3个δ键,还有1对孤对电子,N杂化类型为sp3,
故答案为:sp3;
(7)原子个数相等、价电子数相等的微粒互为等电子体,SO2分子中含有3个原子、价电子数是18,与SO2互为等电子体的分子为O3,
故答案为:O3;
(8)Cr元素为24号元素,原子核外有24个电子,其电子排布式为1s22s22p63s23p63d54s1,则简易电子排布式为[Ar]3d54s1,
故答案为:[Ar]3d54s1;
(9)O原子的核外层8个电子,为1s22s22p4,2p轨道中应为4个单电子,核外电子轨道排布式为: ,
,
故答案为: ;
;
(10)根据图知,该晶胞中距离每个Cu+最近的Cl-的个数为4,氯离子的配位数是4.故答案为:4.
点评 本题考查物质结构和性质,涉及第一电离能大小的比较、氢键、晶胞结构、杂化方式的判断等知识点,侧重考查学生分析、计算能力及空间想象能力,题目难度中等.

| A. | 电池放电时,PbO2是电池的正极,被氧化 | |
| B. | 电池放电时,SO42-只在负极发生反应 | |
| C. | 电池放电时,溶液的pH不断减小 | |
| D. | 电池放电时,正极反应式为PbO2+4H++SO42-+2e-═PbSO4+2H2O |
| A. | 羟基直接连接在苯环上是醇 | |
| B. | 羟基直接连接在苯环侧链碳原子上是醇类物质 | |
| C. | 羟基直接连接在苯环侧链碳原子上是酚类物质 | |
| D. | 含苯环的化合物不可能既含酚羟基又含醇羟基 |
 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 滴入KMnO4(H+)溶液,观察紫色褪去,说明结构中有一定存在不饱和碳碳双键 | |
| C. | 1 mol该物质分别与浓溴水、H2反应时最多消耗Br2和H2分别为4mol、7 mol | |
| D. | 该分子中的所有原子有可能共平面 |
| A. | 氢氧化钡溶液与硫酸的反应OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
| A | B | C | D | |
| 正极 | Cu | Cu | Zn | Al |
| 负极 | Zn | Zn | Cu | Zn |
| 电解质溶液 | H2SO4 | CuSO4 | ZnCl2 | Cu Cl2 |
| A. | A | B. | B | C. | C | D. | D |
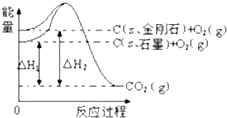
| A. | 石墨转化为金刚石需吸热 | B. | 石墨和金刚石的转化是物理变化 | ||
| C. | 金刚石的稳定性强于石墨 | D. | 石墨和金刚石是同分异构体 |
| A. | 水银温度计不慎被打破,用胶头滴管将水银吸出放入水封的瓶中,残破的温度计插入装有硫粉在广口瓶中 | |
| B. | 用氢气还原氧化铜的实验中,开始应该先点燃酒精灯后通氢气 | |
| C. | 遇到氯气泄漏时,应立即关闭氯气罐,用浸湿食盐水的毛巾捂住口鼻顺风跑至安全处 | |
| D. | 乘坐火车时,严禁携带白磷、汽油、氯化钠等易燃易爆物品 |
 △H=+88.6kJ/mol
△H=+88.6kJ/mol