题目内容
14.下列说法正确的是( )| A. | 等质量的硫蒸气和硫固体分别完全燃烧,相同条件下,前者放出的热量多 | |
| B. | 可逆反应达到平衡,反应就不再进行 | |
| C. | 加入催化剂加快了反应速率,改变了反应吸收或放出的热量 | |
| D. | 同温、同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
分析 A、硫蒸气变化为硫固体为放热过程;
B、可逆反应达到平衡,反应仍在进行;
C、加入催化剂只会改变反应速率;
D、反应的焓变和反应发生的条件没有关系.
解答 解:A、硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,故A正确;
B、可逆反应达到平衡,反应仍在进行,正逆反应速率相等,故B错误;
C、加入催化剂加快了反应速率,但是不会改变反应吸收或放出的热量,故C错误;
D、同温、同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同,故D错误.
故选A.
点评 本题主要考查的是反应热的影响因素和判断知识,综合性较强,注意基本知识的总结是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列实验方案正确的是( )
| A. | 利用与氢气的加成反应除去乙烷中的乙烯得到纯净的乙烷 | |
| B. | 利用溴水鉴别苯和甲苯 | |
| C. | 利用酸性高锰酸钾溶液鉴别乙苯和苯乙烯 | |
| D. | 利用四氯化碳萃取溴水中的溴 |
5.下列分子或离子中,中心原子含有孤对电子的是( )
| A. | NH4+ | B. | CCl4 | C. | SiH4 | D. | PH3 |
9.能正确表示下列化学反应的离子方程式的是( )
| A. | 氢氧化钡溶液与硫酸的反应OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
19.下列说法中正确的是( )
| A. | 凡是含碳元素的化合物都属于有机物 | |
| B. | 易溶于汽油、酒精、苯等有机溶剂中的物质一定是有机物 | |
| C. | 液化石油气(LPG)主要成分是甲烷 | |
| D. | 电石气燃烧放出大量热,常常用于焊接或切割金属 |
3.表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: .
.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(4)用电子式表示元素④与⑥形成的化合物的形成过程 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(5)元素①的氢化物的电子式为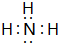 ,该化合物是由极性(填“极性”或“非极性”)键形成的.
,该化合物是由极性(填“极性”或“非极性”)键形成的.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 四 | ⑨ | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
 .
.(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(4)用电子式表示元素④与⑥形成的化合物的形成过程
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)元素①的氢化物的电子式为
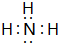 ,该化合物是由极性(填“极性”或“非极性”)键形成的.
,该化合物是由极性(填“极性”或“非极性”)键形成的.
4.利用下图装置收集气体并验证其某些化学性质,正确的( )
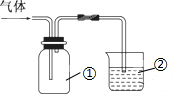

| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | X(能形成酸雨) | KI淀粉溶液 | 溶液变蓝 | X是NO2 |
| B | NH3 | 酚酞溶液 | 溶液变红色 | NH3的水溶液显碱性 |
| C | Cl2 | 紫色石蕊试液 | 溶液立即褪色 | Cl2有氧化性 |
| D | SO2 | 溴水 | 溶液褪色 | SO2有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
 有机物的结构可用“键线式”表示,如:
有机物的结构可用“键线式”表示,如: 可简写为
可简写为 ,
, 可简写为
可简写为  .玫瑰的香味物质中包含苧烯,苧烯的键线式如图,苧烯的分子式为C10H16.
.玫瑰的香味物质中包含苧烯,苧烯的键线式如图,苧烯的分子式为C10H16.