题目内容
9.下列化合物中,核磁共振氢谱只出现两组峰且峰面积之比为3:2的是( )| A. | 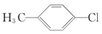 | B. | 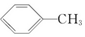 | C. | 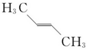 | D. |  |
分析 核磁共振氢谱只出现两组峰且峰面积之比为3:2,可知结构中含2种H,且原子数比为3:2,以此来解答.
解答 解:A. 中含3种H,故A不选;
中含3种H,故A不选;
B. 中含4种H,故B不选;
中含4种H,故B不选;
C. 中含2种H,峰面积之比为3:1,故C不选;
中含2种H,峰面积之比为3:1,故C不选;
D. 中含2种H,且原子数比为3:2,峰面积之比为3:2,故D选;
中含2种H,且原子数比为3:2,峰面积之比为3:2,故D选;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、等效H的判断为解答的关键,侧重分析与应用能力的考查,注意H原子数目与峰面积比的关系,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下面表格中的实验操作、实验现象和结论均正确且相符的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将浓硫酸滴加到蔗糖中搅拌 | 固体变黑膨胀 | 浓硫酸有吸水性 |
| B | 将盐酸缓缓滴入Na2CO3溶液中 | 无气泡产生 | 二者不反应 |
| C | 向某溶液中加入浓NaOH溶液并加热,在试管口用湿润红色石蕊纸检验 | 试纸变蓝 | 原溶液中含有NH4+ |
| D | 向氢氧化铁胶体中滴加氯化铵饱和溶液 | 产生沉淀 | 沉淀为FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
17. 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.
(1)①硫离子的结构示意图为 .
.
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
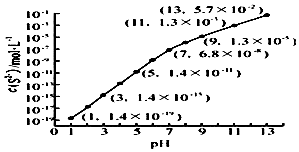
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=5时,Mn2+开始沉淀.1已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
足量NaHSO3溶液与NaHCO3溶液反应的离子方程式为2HSO3-+CO32-=2SO32-+CO2↑+H2O.
 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.(1)①硫离子的结构示意图为
 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
(3)25℃,两种酸的电离平衡常数如表.
足量NaHSO3溶液与NaHCO3溶液反应的离子方程式为2HSO3-+CO32-=2SO32-+CO2↑+H2O.
14.已知硅酸盐中,通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.Si2O44-四面体可用图(a)表示.图(b)是一种无限长单链结构的多硅酸根,其化学式为( )

| A. | Si2O76- | B. | Si2O52- | C. | SiO32- | D. | Si4O116- |
1.如表是元素周期表的一部分,有关说法中正确的是( )
①a、b、e、f四种元素的原子半径:e>f>b>a
②h、i两种元素阴离子的还原性:h>i
③a、g两种元素的氢化物的稳定性:a>g
④d、e、f三种元素的最高价氧化物对应的水化物碱性依次增强
⑤九种元素中d元素的单质还原性最强.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | |
| 二 | a | b | c | ||||
| 三 | d | e | f | g | h | i |
②h、i两种元素阴离子的还原性:h>i
③a、g两种元素的氢化物的稳定性:a>g
④d、e、f三种元素的最高价氧化物对应的水化物碱性依次增强
⑤九种元素中d元素的单质还原性最强.
| A. | ①③④ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③⑤ |
18.X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如表所示:
请回答下列问题:
(1)W位于周期表中第三周期,第ⅦA族;
(2)X可形成双原子分子,其分子的电子式是 ;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.
;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
(4)将0.20molZY2和0.10molO2充入一个固定容积为5L的密闭容器中,在一定温度并有催化剂存在下,进行反应,经半分钟达到平衡,测得溶液中含YZ30.18mol,则v(O2)=0.036mol/(L•min);若温度不变,继续通入0.20molYZ2和0.10molO2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36mol<n(YZ3)<0.40mol.
| X | Y | |
| Z | W |
(1)W位于周期表中第三周期,第ⅦA族;
(2)X可形成双原子分子,其分子的电子式是
 ;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.
;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
(4)将0.20molZY2和0.10molO2充入一个固定容积为5L的密闭容器中,在一定温度并有催化剂存在下,进行反应,经半分钟达到平衡,测得溶液中含YZ30.18mol,则v(O2)=0.036mol/(L•min);若温度不变,继续通入0.20molYZ2和0.10molO2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36mol<n(YZ3)<0.40mol.