题目内容
18.某温度下,浓度都是1mol/L两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的浓度为 (X2)=0.4mol/L,c(Y2)=0.8mol/L,c(Z)=0.4mol/L,则该反应的反应式可表示为( )| A. | X2+2Y2=2Z | B. | 2X2+2Y2=2Z | C. | 3X2+Y2=2Z | D. | X2+3Y2=2Z |
分析 计算各物质的浓度变化量,利用浓度变化量之比等于化学计量数之比,据此确定各物质的化学计量数,再利用原子守恒用X、Y表示Z的组成,据此书写方程式.
解答 解:t min后,△c(X2)=1mol•L-1-0.4mol•L-1=0.6mol•L-1,
△c(Y2)=1mol•L-1-0.8mol•L-1=0.2mol•L-1,
△c(Z)=0.4mol•L-1,
则X2、Y2、Z的化学计量数之比为=0.6mol•L-1:0.2mol•L-1:0.4mol•L-1=3:1:2,
故反应为3X2+Y2═2Z,根据原子守恒可知,Z为X2Y,
故反应可以表示为:3X2+Y2═2X2Y,
故选C.
点评 本题考查化学反应速率的有关计算,题目难度不大,根据物质的量浓度变化量之比等于化学计量数之比确定各物质的化学计量数是关键.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
8.下列物质中,只含有共价键的是( )
| A. | Na2O | B. | NaCl | C. | HCl | D. | NaOH |
9.巴豆酸的结构简式为CH3-CH═CH-COOH.现有:①氯化氢、②溴水、③纯碱溶液、④乙醇、⑤酸性高锰酸钾溶液,试根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸反应的物质是( )
| A. | 只有②④⑤ | B. | 只有①③④ | C. | 只有①②③⑤ | D. | ①②③④⑤ |
6.下列有关化学用语表示正确的是( )
| A. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| B. | N2的电子式: | |
| C. | S2-的结构示意图: | |
| D. | 甲烷分子的比例模型是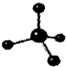 |
13.将1molCH4和适量的O2在密闭容器中点燃,充分反应后,CH4和O2均无剩余,且产物均为气体(101kPa,120℃),总质量为72g,下列有关叙述不正确的是( )
| A. | 若将产物通过碱石灰,则不能被完全吸收 | |
| B. | 若将产物通过浓硫酸,充分吸收后,浓硫酸增重18g | |
| C. | 产物的平均摩尔质量为24g.mol-1 | |
| D. | 反应中消耗O256g |
3.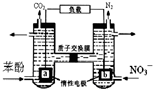 我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是:( )
我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是:( )
 我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是:( )
我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是:( )| A. | a为正极 | |
| B. | 若右池产生0.672L气体(标况下),则转移电子0.15mol | |
| C. | 左池电极反应式为C6H6O+11H2O-28e-═6CO2↑+28H+ | |
| D. | 左池消耗的苯酚与右池消耗的NO3-的物质的量之比为28:5 |
10.如图实验不合理的是( )
| A. |  证明元素非金属性强弱 S>C>Si | B. |  四氯化碳萃取碘水中的碘 | ||
| C. |  制备并收集少量NO气体 | D. |  制备少量氧气 |
7.关于金属锂的叙述中,错误的是( )
| A. | 与水反应时,比钠更剧烈 | B. | 它的原子半径比钠的小 | ||
| C. | 它是密度最小的碱金属 | D. | 它可以做还原剂 |
8.下列物质中所有原子均满足最外层8电子稳定结构的化合物是( )
| A. | BF3 | B. | P4 | C. | CO2 | D. | NH3 |