题目内容
9.下列叙述正确的是( )| A. | O2分子间存在着非极性共价键 | |
| B. | CO2分子内存在着极性共价键 | |
| C. | SO2与H2O反应的产物是离子化合物 | |
| D. | 盐酸中含有H+和Cl-,故HCl为离子化合物 |
分析 A.分子间没有共价键;
B.不同非金属原子间存在极性共价键;
C.SO2与H2O反应生成亚硫酸,酸都是共价化合物;
D.HCl中Cl原子与H原子间通过共用电子对结合在一起.
解答 解:A.分子间没有共价键,分子间只存在分子间作用力,故A错误;
B.不同非金属原子间存在极性共价键,所以CO2分子内存在着极性共价键,故B正确;
C.SO2与H2O反应生成亚硫酸,酸都是共价化合物,所以亚硫酸不是离子化合物,故C错误;
D.HCl中Cl原子与H原子间通过共用电子对结合在一起,HCl属于共价化合物,故D错误.
故选B.
点评 本题考查了化学键,题目难度不大,注意把握共价键、离子键、共价化合物和离子化合物的区别,侧重于考查学生对基础知识的掌握情况.

练习册系列答案
相关题目
4.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为5NA | |
| C. | 1 mol甲基的电子数目为7NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其所含原子总数为3NA |
14.下列说法中,正确的是( )
| A. | 在周期表中,族序数都等于该族元素的最外层电子数 | |
| B. | 同一主族的两种元素的原子序数之差可能是44 | |
| C. | 卤素单质随原子序数的增大,其熔沸点逐渐降低 | |
| D. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q |
1. 在AlCl3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgSO4的物质的量浓度之比为( )
在AlCl3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgSO4的物质的量浓度之比为( )
 在AlCl3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgSO4的物质的量浓度之比为( )
在AlCl3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgSO4的物质的量浓度之比为( )| A. | 1:1 | B. | 3:1 | C. | 2:1 | D. | 1:2 |
18.用氯气消毒过的自来水配制下列溶液时,会使所配溶液的溶质发生变化的是( )
①NaOH ②AgNO3 ③Na2CO3 ④NaBr ⑤FeCl2.
①NaOH ②AgNO3 ③Na2CO3 ④NaBr ⑤FeCl2.
| A. | 只有①② | B. | 只有①④⑤ | C. | 只有②④⑤ | D. | ①②③④⑤ |
19.下列物质中,可作为绿色燃料的是( )
| A. | 汽油 | B. | 煤 | C. | 石油 | D. | 氢气 |
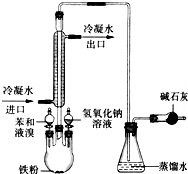 如图是实验室制取溴苯的装置图.
如图是实验室制取溴苯的装置图.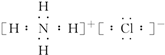 .
.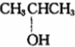 ⑨${\;}_{6}^{13}$C
⑨${\;}_{6}^{13}$C 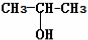 .
.