题目内容
3.下列化合物中既有离子键又有共价键的是( )| A. | MgCl2 | B. | NaOH | C. | HBr | D. | N2 |
分析 活泼金属和活泼金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答.
解答 解:A.氯化镁中镁离子和氯离子之间只存在离子键,故A错误;
B.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,故B正确;
C.HBr中H-Br原子之间只存在共价键,故C错误;
D.氮气分子中N-N原子之间只存在共价键,故D错误;
故选B.
点评 本题考查离子键和共价键的判断,为高频考点,侧重考查基本概念,明确离子键和共价键的区别是解本题关键,注意A中不含共价键,为易错点.

练习册系列答案
相关题目
13.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 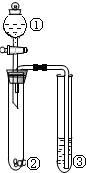 |
| A | 稀盐酸 | 石灰石 | 稀的碳酸钠溶液 | 溶解度:碳酸钠>碳酸氢钠 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸有脱水性、强氧化性 | |
| C | 浓硫酸 | Na2SO3 | 品红溶液 | 浓硫酸具有强氧化性 | |
| D | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 酸性:盐酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
18.下列装置工作-段时间后.各池出现了不同现象.下列有关说法不正确的
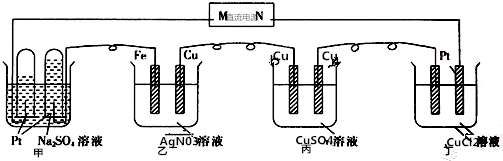

| A. | N为直流电源的正极 | |
| B. | 乙池的总反应为4AgN03+2H20═4Ag+4HNO3+O2↑ | |
| C. | 丙池的反应符合电解精炼铜原理 | |
| D. | 要使丁池电解质溶液复原,需加适量的CuCl2 |
15.向氯水中加入下列物质,表中各项均正确的是( )
| 选项 | 加入物质 | 现象 | 解释或离子方程式 |
| A | AgNO3溶液 | 有白色沉淀生成 | Cl-+Ag+═AgCl↓ |
| B | 石蕊试液 | 显红色 | 氯水中有盐酸、次氯酸 |
| C | CaCO3 | 有气体放出 | CO32-+2H+═H2O+CO2↑ |
| D | FeCl2和KSCN溶液 | 有红色沉淀生成 | 2Fe2++Cl2═2Fe3++2Cl- |
| A. | A | B. | B | C. | C | D. | D |
12.已知相同温度下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
| A. | 水的电离程度始终增大 | |
| B. | c(NH4+):c(NH3•H2O)始终减小 | |
| C. | c(CH3COOH)与c(CH3COO?)之和始终保持不变 | |
| D. | 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-) |
13.如表是甲同学研究氯水性质实验片段的活动记录.
(1)根据上述实验内容和现象,选择合理解释填到表中(填序号)
A.氯化中存在Cl-
B.氯水中有漂白性物质和酸性物质
C.氯水中存在Cl2分子
(2)甲同学在实验中运用了AD进行探究(填序号)
A.观察法 B.比较法 C.分类法 D.实验法
(3)乙同学在甲同学的实验基础上设计了如图实验装置进一步研究氯气的性质.
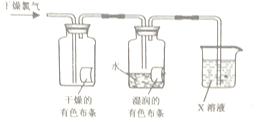
回答下列问题:
①实验中,乙同学观察到干燥的有色布条不褪色,湿润的有色布条褪色,得出的实验结论是干燥氯气没有漂白性.
②为了防止多余的氯气污染空气,实验室常用X溶液来吸收尾气,写出X的化学式NaOH.
| 实验内容 | 实验现象 | 解释及结论 |
| 观察氯水的颜色、状态 | 呈黄绿色 | ① C |
| 向氯水中滴入几滴硝酸银溶液 | 有白色沉淀 | ② A |
| 用玻璃棒蘸取氯水,点在蓝色石蕊试纸上 | 滴有氯水的试纸中间变白,外圈变红 | ③ B |
A.氯化中存在Cl-
B.氯水中有漂白性物质和酸性物质
C.氯水中存在Cl2分子
(2)甲同学在实验中运用了AD进行探究(填序号)
A.观察法 B.比较法 C.分类法 D.实验法
(3)乙同学在甲同学的实验基础上设计了如图实验装置进一步研究氯气的性质.

回答下列问题:
①实验中,乙同学观察到干燥的有色布条不褪色,湿润的有色布条褪色,得出的实验结论是干燥氯气没有漂白性.
②为了防止多余的氯气污染空气,实验室常用X溶液来吸收尾气,写出X的化学式NaOH.
 请回答:
请回答: