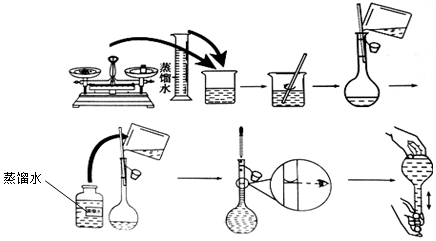
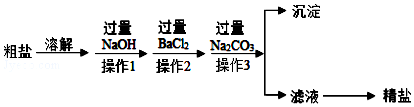
题目内容
8.用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子.请回答:(1)氨水吸收过量SO2的反应的离子方程式为NH3•H2O+SO2=NH4++HSO3-.
(2)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/LHNO3、1mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
实验操作
预期现象与结论
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量.
若出现白色浑浊,则溶液中存在SO32-或 SO42-.
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体滴入 1滴(或 少量)品红溶液,再滴入 过量2mol/L 盐酸,振荡若品红 褪色(或有气泡),则“吸收液”中 存在SO32-.
步骤3:用试管 取适量滤液,向其中 滴入过量的1mol/L Ba(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L 盐酸],振荡,若出现 白色沉淀(或品红溶液 褪色,或有气泡,),则“吸收液”中存在HSO3-.
分析 (1)过量二氧化硫和氨水反应生成亚硫酸氢铵;
(2)依据SO32-和HSO3-离子的性质和检验方法设计实验进行检验设计;结合题干信息和条件,取少量于小烧杯中加入过量氯化钡反应生成沉淀为亚硫酸钡或硫酸钡沉淀;取沉淀加入酸的生成二氧化硫,通过检验二氧化硫的存在方法验证亚硫酸根离子的存在;取滤液依据亚硫酸氢根离子和酸反应可以生成二氧化硫,检验二氧化硫完成实验设计,或通过亚硫酸氢根离子和氢氧化钡反应生成沉淀分析判断.
解答 解:(1)氨水吸收过量SO2,反应生成亚硫酸氢铵,反应的离子方程式为:NH3•H2O+SO2=NH4++HSO3-,
故答案为:NH3•H2O+SO2=NH4++HSO3-;
(2)依据SO32-和HSO3-离子的性质和检验方法设计实验进行检验设计;结合题干信息和条件,取少量于小烧杯中加入过量氯化钡反应生成沉淀为亚硫酸钡或硫酸钡沉淀;取沉淀加入酸的生成二氧化硫,通过检验二氧化硫的存在方法验证亚硫酸根离子的存在;取滤液依据亚硫酸氢根离子和酸反应可以生成二氧化硫,检验二氧化硫完成实验设计,或通过亚硫酸氢根离子和氢氧化钡反应生成沉淀分析判断;实验设计方法和步骤为:
步骤2:滴入 1滴(或 少量)品红溶液,再滴入 过量2mol/L 盐酸,振荡若品红 褪色(或有气泡),则“吸收液”中 存在SO32-.
步骤3:用试管 取适量滤液,向其中 滴入过量的1mol/L Ba(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L 盐酸],振荡,
若出现 白色沉淀(或品红溶液 褪色,或有气泡,),则“吸收液”中存在HSO3-.
故答案为:滴入 1滴(或 少量)品红溶液,再滴入 过量2mol/L 盐酸,振荡若品红 褪色(或有气泡),则“吸收液”中 存在SO32-;
用试管 取适量滤液,向其中 滴入过量的1mol/L Ba(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L 盐酸],振荡,若出现 白色沉淀(或品红溶液 褪色,或有气泡,),则“吸收液”中存在HSO3-.
点评 本题考查了二氧化硫性质的实验验证方法和实验设计分析步骤,掌握实验基础和离子性质、离子检验方法,正确选择试剂,描述反应现象,题目难度中等.

| A. | 乙烯与水在一定条件下生成乙醇的反应属于取代反应 | |
| B. | 在一定条件下,苯分别与液溴、混酸(浓硝酸和浓硫酸)作用生成溴苯、硝基苯的反应都属于取代反应 | |
| C. | 氯乙烯分子的结构简式为H3C-CH2Cl | |
| D. | SO2使溴水褪色与乙烯使溴水褪色的原理相同 |
| A. | 钢铁制品的腐蚀常以析氢腐蚀为主 | |
| B. | 厨房中常用碳酸钠溶液洗涤餐具上的油污 | |
| C. | 明矾用于水的杀菌消毒 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 |
(1)在①②③④的操作中需要用到玻璃棒的是①②③(填序号).
(2)为检验草木灰中的离子,取少量晶体溶于水,并把溶液分成四份,完成以下实验报告(在横线上填写相关的内容):
| 实验步骤 | 实验现象 | 实验结论 |
Ⅰ.取第一份溶液和适量稀盐酸加入下列装置的试管中,把澄清的石灰水加入烧杯中 | 导管口有气泡, | 证明含有CO32- |
| Ⅱ.取第二份溶液,先滴加稀盐酸后加 | 证明含有SO42- | |
| Ⅲ.取第三份溶液加入过量BaCl2溶液,过滤,除去SO42-和CO32-,再滴加AgNO3溶液和稀硝酸 | 有白色沉淀生成 | 证明含有Cl- |
| Ⅳ.取第四份溶液进行焰色反应 | 透过蓝色钴玻璃火焰呈紫色 | 证明含有K+ |