题目内容
18.草木灰中含有可溶性钾盐(主要成分是K2SO4、K2CO3、KCl).某学生按下列操作提取草木灰中的钾盐:①取草木灰加水溶解;②过滤、取滤液;③蒸发滤液;④冷却结晶.(1)在①②③④的操作中需要用到玻璃棒的是①②③(填序号).
(2)为检验草木灰中的离子,取少量晶体溶于水,并把溶液分成四份,完成以下实验报告(在横线上填写相关的内容):
| 实验步骤 | 实验现象 | 实验结论 |
Ⅰ.取第一份溶液和适量稀盐酸加入下列装置的试管中,把澄清的石灰水加入烧杯中 | 导管口有气泡, | 证明含有CO32- |
| Ⅱ.取第二份溶液,先滴加稀盐酸后加 | 证明含有SO42- | |
| Ⅲ.取第三份溶液加入过量BaCl2溶液,过滤,除去SO42-和CO32-,再滴加AgNO3溶液和稀硝酸 | 有白色沉淀生成 | 证明含有Cl- |
| Ⅳ.取第四份溶液进行焰色反应 | 透过蓝色钴玻璃火焰呈紫色 | 证明含有K+ |
分析 (1)①③需要玻璃棒搅拌,②需要玻璃棒引流,④中不需要;
(2)检验草木灰中的离子,焰色反应检验钾离子,加盐酸、氯化钡等可检验碳酸根离子;
(3)步骤Ⅲ中引入氯离子,干扰实验.
解答 解:(1)①③需要玻璃棒搅拌,②需要玻璃棒引流,④中不需要,则①②③的操作中需要用到玻璃棒,
故答案为:①②③;
(2)检验草木灰中的离子,加盐酸有气泡产生,则含碳酸根离子;
取第二份溶液,先别滴加稀盐酸,后加氯化钡溶液,若生成白色沉淀,含硫酸根离子;
取第三份溶液加入过量BaCl2溶液,过滤,除去SO42-和CO32-,再滴加AgNO3溶液和稀硝酸,有白色沉淀生成,为AgCl;
取第四份溶液进行焰色反应,透过蓝色钴玻璃火焰呈紫色,则含钾离子,
故答案为:
| 实验步骤 | 实验现象 | 实验结论 |
Ⅰ.取第一份溶液和适量稀盐酸加入下列装置的试管中,把澄清的石灰水加入烧杯中 | 导管口有气泡, | 证明含有碳酸根离子 |
| Ⅱ.取第二份溶液,先别滴加稀盐酸,后加 氯化钡 | 白色沉淀 | 证明含有硫酸根离子 |
| Ⅲ.取第三份溶液加入过量BaCl2溶液,过滤,除去SO42-和CO32-,再滴加AgNO3溶液和稀硝酸 | 有白色沉淀生成 | 证明含有氯离子 |
| Ⅳ.取第四份溶液进行焰色反应 | 透过蓝色钴玻璃 火焰呈紫色 | 证明含有K+ |
(3)步骤Ⅲ中引入氯离子,干扰实验,应选硝酸钡,则不合理,
故答案为:否;将氯化钡改为硝酸钡.
点评 本题考查物质的组成及物质的鉴别,为高频考点,把握实验基本操作及离子之间的反应为解答的关键,侧重物质性质及反应现象的考查,注意常见离子的检验,题目难度不大.

练习册系列答案
相关题目
9.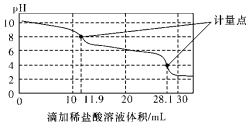 实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量.称取1.59g样品,溶于水配成250.00mL溶液,取出该溶液25.00mL用0.1mol•L-1盐酸进行滴定,得到如图曲线.以下说法或操作正确的是( )
实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量.称取1.59g样品,溶于水配成250.00mL溶液,取出该溶液25.00mL用0.1mol•L-1盐酸进行滴定,得到如图曲线.以下说法或操作正确的是( )
 实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量.称取1.59g样品,溶于水配成250.00mL溶液,取出该溶液25.00mL用0.1mol•L-1盐酸进行滴定,得到如图曲线.以下说法或操作正确的是( )
实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量.称取1.59g样品,溶于水配成250.00mL溶液,取出该溶液25.00mL用0.1mol•L-1盐酸进行滴定,得到如图曲线.以下说法或操作正确的是( )| A. | 上一个计量点前发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ | |
| B. | 下一个计量点溶液中存在大量的阴离子是Cl-、HCO3- | |
| C. | 此样品n(NaHCO3)=(28.1-2×11.9)×10-4 mol | |
| D. | 使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点 |
6.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,2.3 g Na变成Na2O2时,失去0.2NA个电子 | |
| B. | 常温常压下,32 g氧气和32 g臭氧都含有2NA个氧原子 | |
| C. | 含0.2 mol NaOH的溶液中含有NA个Na+离子 | |
| D. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA |
3.除去下列溶液中的杂质(括号内为杂质),选择试剂不正确的是( )
| A. | CO2(HCl)--用饱和NaHCO3溶液 | B. | NaOH(Ba(OH)2)--用Na2SO4溶液 | ||
| C. | NaCl(Na2SO4)--用Ba(NO3)2溶液 | D. | Na2CO3(NaHCO3)--用NaOH溶液 |
10.下列物质与水混合后,显著放热的是( )
| A. | 生石灰 | B. | 无水乙醇 | C. | 浓硫酸 | D. | 固体硝酸铵 |
7.下列说法正确的是( )
| A. | 离子化合物中只能含有离子键 | |
| B. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 | |
| C. | 化学键存在于分子之间 | |
| D. | 共价化合物中可能含有离子键 |