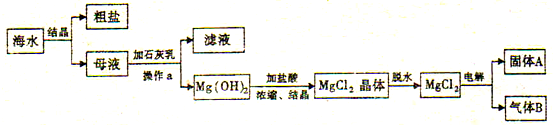
题目内容
13.下列叙述错误的是( )| A. | 13C和14C属于同一种元素,它们互为同位素 | |
| B. | LiH、LiD、LiT的摩尔质量之比为8:9:10 | |
| C. | 两原子如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
分析 A.质子数相同中子数不同的同一元素互称同位素;
B.摩尔质量以g/mol为单位,在数值等于物质的相对分子质量;
C.两原子的核外电子排布相同,一定互为同位素原子;
D.阴离子的核外电子排布一定与本周期的稀有气体原子的核外电子排布相同.
解答 解:A.13C与14C质子数相同属于同一种元素,中子数分别是6,7,它们互为同位素,故A正确;
B.摩尔质量以g/mol为单位,在数值等于物质的相对分子质量,LiH、LiD、LiT的摩尔质量之比应为8:9:10,故B正确;
C.两原子的核外电子排布相同,一定互为同位素原子,属于同一元素,故C正确;
D.原子获得电子形成阴离子,最外层呈稳定结构,电子层数目不变,阴离子的核外电子排布一定与本周期的稀有气体原子的核外电子排布相同,不是“上一周期”,故D错误.
故选D.
点评 本题综合考查同位素、摩尔质量、原子构成,侧重于学生的分析能力的考查,注意把握元素周期表的结构和元素周期律的递变规律,难度不大.

练习册系列答案
相关题目
4.要使含有Ag+、Mg2+、Ba2+等溶液中的离子逐一形成沉淀析出,下列所选择的试剂及加入试剂的顺序正确的是( )
| A. | H2SO4→HCl→NaOH→CO2 | B. | Na2SO4→NaCl→NH3•H2O | ||
| C. | NaCl→Na2SO4→NaOH | D. | Na2SO4→NaCl→NaOH |
1.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )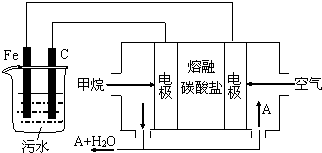

| A. | 该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,则负极的电极反应是CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣,此时,可以向污水中加入适量的稀H2SO4 | |
| C. | 实验过程中,若阴极产生2mol气体,则燃料电池消耗11.2L CH4 | |
| D. | 为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A参加循环,则A物质是CO32- |
8.电解水﹙H2O﹚和重水﹙D2O﹚的混合物,通电一定时间后,两极共生成气体18.5克,体积为33,6L﹙标况﹚,所生成的气体中重氢﹙D﹚和普氢﹙H﹚的原子个数比是( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
18.下列各离子方程式中,属于水解反应的是( )
| A. | HCO3-+H2O?H3O++CO32- | B. | NH4++H2O?NH3•H2O+OH- | ||
| C. | PO43-+H2O?HPO42-+OH- | D. | H2O+H2O?H3O++OH- |
5.中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是( )
| A. | 根据氧化还原反应的规律,推出强氧化剂遇到强还原剂一定会发生氧化还原反应 | |
| B. | 根据化学反应的规律,推出氢氧化铁可通过化合反应得到 | |
| C. | 根据元素的非金属性较强,其单质也越活泼规律,推出磷单质比N2稳定得多 | |
| D. | 根据CO2通入Ba(NO3)2溶液中无沉淀的规律推测,SO2入Ba(NO3)2溶液中也无沉淀产生 |
2.下列各组物质全部是弱电解质的是( )
| A. | H2SiO3.H2S CO2 | |
| B. | H2O NH3•H2O HClO.HF | |
| C. | H2SO3 Ba(OH)2 BaSO4 | |
| D. | Cu(OH)2 CH3COOH C2H5OH CH3COONa |
3.一定温度下,将浓度为a mol•L-1的Na2S溶液加水不断稀释,下列各量始终保持减小的是( )
| A. | c(OH-) | B. | Kh(Na2S) | C. | $\frac{c({H}^{+})}{c({S}^{2-})}$ | D. | $\frac{c(N{a}^{+})}{c({S}^{2-})}$ |