题目内容
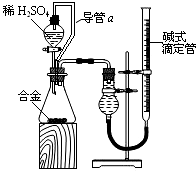
20. 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入6mol/L的硫酸溶液中,乙同学将电极放入6mol/L的NaOH溶液中,实验装置如图所示:
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入6mol/L的硫酸溶液中,乙同学将电极放入6mol/L的NaOH溶液中,实验装置如图所示:(1)写出甲中正极的电极反应式:2H++2e-=H2↑.
(2)写出乙中负极的电极反应式:Al+4OH--3e-=AlO2-+2H2O,总反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)若乙装置设计为氢气燃料电池,两极改为惰性电极,则负极反应式为H2+2OH--2e-=2H2O.
若乙装置设计为甲烷燃料电池,两极改为惰性电极,则负极反应式为CH4+10OH--8e-=CO32-+7H2O.
分析 甲同学依据的化学反应原理是Mg+H2SO4=MgSO4+H2↑,乙同学依据的化学反应原理是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由于Al显两性,与酸碱都能反应,
(1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应;
(2)乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应;
(3)若乙装置设计为氢气燃料电池,两极改为惰性电极,电解质溶液为碱,故则负极反应式为H2+2OH--2e-=2H2O;甲烷燃料电池以NaOH溶液为电解质溶液时,负极上是甲烷发生失电子的氧化反应,又因为电解质是NaOH溶液,二氧化碳和氢氧化钾反应得到的是碳酸钾,即CH4+10OH--8e-=CO32-+7H2O.
解答 解:(1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应,负极反应为Mg-2e-=Mg2+,正极反应为2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
(2)乙池中铝易失电子作负极,负极上铝失电子发生氧化反应,电极反应式为:Al+4OH--3e-=AlO2-+2H2O,镁作正极,正极发生还原反应,总反应为2Al+2OH-+2H2O=AlO2-+3H2↑,
故答案为:Al+4OH--3e-=AlO2-+2H2O;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)若乙装置设计为氢气燃料电池,两极改为惰性电极,电解质溶液为碱,故则负极反应式为H2+2OH--2e-=2H2O;甲烷燃料电池以NaOH溶液为电解质溶液时,负极上是甲烷发生失电子的氧化反应,又因为电解质是NaOH溶液,二氧化碳和氢氧化钾反应得到的是碳酸钾,即CH4+10OH--8e-=CO32-+7H2O,故答案为:H2+2OH--2e-=2H2O;CH4+10OH--8e-=CO32-+7H2O.
点评 本题考查了探究原电池原理,题目难度中等,明确原电池中各个电极上发生的反应是解本题关键,注意不能根据金属的活动性强弱判断正负极,要根据失电子难易程度确定负极,注意电解质溶液是否参与反应,为易错点.

 黄冈创优卷系列答案
黄冈创优卷系列答案| A. | CH3CH2CH2CH2CH3和 互为同分异构体 互为同分异构体 | |
| B. | 干冰和冰为同一种物质 | |
| C. | CH3CH3和CH3CH2CH3互为同系物 | |
| D. | 12C和14C互为同位素 |
| 元素 | 有关信息 |
| X | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
| Y | M层上有3个电子 |
| Z | 短周期元素中原子半径最大的主族元素 |
| W | 其单质是淡黄色固体 |
| Q | 最高正价与最低负价代数和为6 |
| A. | 简单离子的半径大小顺序为:W>Q>Z>Y | |
| B. | W单质在氧气中燃烧后的产物不能使品红溶液褪色 | |
| C. | X、W和氢三种元素形成的化合物中只有共价键 | |
| D. | Z与W元素只能形成原子个数比为2:1的化合物 |
| A. | 0.1mol铜粉在0.05mol氯气中充分燃烧,转移电子数为0.2NA | |
| B. | 常温常压下,22.4L氙气中含有NA个氙分子 | |
| C. | 一定量的浓H2SO4与0.1molMg恰好完全反应,生成SO2为0.1NA | |
| D. | 标准状况下,22.4L由SO2和O3组成的混合气体中含有3NA个原子 |
(1)则另一未知元素为Na(填化学式).
(2)①该化合物W的化学式为NaFeO2.
②该化合物W与适量稀硫酸反应的化学方程式2NaFeO2+4H2SO4=Na2SO4+Fe2(SO4)3+4H2O.
(3)草酸钴是广泛应用于磁性材料、电池材料、及超硬材料等领域.某研究小组在实验室探究CoC2O4分解反应的平衡常数.将一定量纯净的CoC2O4粉末置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解的平衡:
CoC2O4(S)?CoO(S)+CO(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 240 | 250 | 260 | 270 |
| 平衡总压强/kp | 5.7 | 8.3 | 12.0 | 17.1 |
| 平衡总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 |
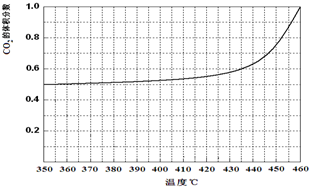
(4)温度加热至350℃,CO2的体积分数开始发生变化,体积分数和温度的关系如下:
试画出CO的体积分数随温度升高的曲线
(1)根据要求,选择恰当的选项用字母代号填空:
①“含氟牙膏”中的氟应理解为A.
A.元素 B.单质 C.离子
②下列物质中含有有机高分子材料的是C;
A.普通水泥 B.普通玻璃 C.汽车轮胎
③糖类、油脂、蛋白质、无机盐、水、维生素是人类不可缺乏的营养物质.下列维生素中,可用于防治坏血病的是C.
A.维生素A B.维生素B1 C.维生素C
④抗生素药有阻止多种细菌生长的功能,下列药物属于抗生素药的是B.
A.阿司匹林 B.青霉素 C.抗酸药(氢氧化铝)
⑤下列处理垃圾的方法中,不正确的是C.
A.回收利用废纸 B.回收利用易拉罐 C.填埋废旧电池
(2)在全球每年被腐蚀的钢铁中,电化学腐蚀比化学腐蚀所占比例高(填“高”或“低”).
(3)下表所列的一些物质都是家庭常用物质,请根据实验要求,选择合适的化学试剂,将其字母代号填入对应的空格中.
| 实验要求 | 化学试剂 | 供选择的化学试剂 |
| 检验味精中是否含有食盐 | A.新制氢氧化铜悬浊液 B.硝酸银溶液和稀硝酸 C.碘水 D.碳酸钠粉末 | |
| 检验地瓜粉中是否含有淀粉 | ||
| 检验食醋中是否含有乙酸 | ||
| 区别蔗糖和葡萄糖 |
 ,(若产物中有水生成则省略未表示出来).
,(若产物中有水生成则省略未表示出来).